Перейти к:
Комбинированное применение кабозантиниба и ниволумаба в клинической практике
https://doi.org/10.24060/2076-3093-2024-14-1-94-100
Аннотация
Введение. В статье обсуждается рак почки, одно из распространенных злокачественных заболеваний. Рассматриваются исторические и современные методы лечения, включая ингибиторы тирозинкиназы и ингибиторы иммунной контрольной точки. Обсуждаются результаты клинических исследований, оценивающих эффективность комбинаций лекарственной терапии, в том числе комбинаций ингибиторов иммунной контрольной точки с ангиогенезом направленной терапии.
Материалы и методы. Представлен случай лечения пациентки с метастатическим светлоклеточным раком почки и множественными метастазами в легкие. Диагноз был установлен на основании данных компьютерной томографии и выставлен без верификации. В ходе лечения были использованы различные режимы терапии, включая пазопаниб, ниволумаб и комбинацию ниволумаба с кабозантинибом.
Результаты и обсуждение. Результаты контрольных обследований показали стабилизацию заболевания и нормальную переносимость терапии. В конечном итоге пациентка была подвергнута лапароскопической циторедуктивной нефрэктомии. Терапия ниволумабом в комбинации с кабозантинибом продолжается на настоящий момент.
Заключение. На сегодня комбинированное применение кабозантиниба и ниволумаба является перспективной стратегией лечения почечно-клеточного рака, в которой кабозантиниб препятствует прогрессированию опухоли. Ниволумаб, в свою очередь, повышает активность иммунной системы и способствует разрушению опухолевых клеток.
Ключевые слова
Для цитирования:
Аскаров В.Е., Султанбаев А.В., Меньшиков К.В., Мусин Ш.И., Султанбаева Н.И., Попова Е.В., Меньшикова И.А. Комбинированное применение кабозантиниба и ниволумаба в клинической практике. Креативная хирургия и онкология. 2024;14(1):94-100. https://doi.org/10.24060/2076-3093-2024-14-1-94-100
For citation:
Askarov V.E., Sultanbaev A.V., Menshikov K.V., Musin Sh.I., Sultanbaeva N.I., Popova E.V., Menshikova I.A. Combined Use of Cabozantinib and Nivolumab in Clinical Practice. Creative surgery and oncology. 2024;14(1):94-100. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-1-94-100
ВВЕДЕНИЕ
Рак почки является распространенным злокачественным заболеванием с более чем 430 000 новых случаев, зарегистрированных во всем мире в 2020 году, что привело к примерно 180 000 смертей [1]. Почечно-клеточный рак (ПКР) составляет большинство случаев рака почек (90–95 %), при этом светлоклеточный ПКР является наиболее распространенным гистологическим подтипом [2][3]. Примерно 30 % случаев ПКР диагностируются на поздней или метастатической стадии, и около 80 % этих пациентов имеют заболевание промежуточного или низкого риска в соответствии с критериями IMDC [24]. ПКР характеризуется инактивацией гена супрессора опухоли фон Хиппеля-Линдау, что приводит к высокой экспрессии проангиогенного фактора роста эндотелия сосудов (VEGF) [5–7].
До недавнего времени основа терапии первой линии для прогрессирующего ПКР включала ингибирование ангиогенеза ингибиторами тирозинкиназы (TKI) против множества рецепторов, включая рецепторы VEGF (например, сунитиниб и пазопаниб) [8][9]. Исторические критерии для медианной общей выживаемости (ОВ) в эпоху целевой терапии VEGF группами риска IMDC составили 43, 23 и 8 месяцев для благоприятных (IMDC 0), промежуточных (IMDC 1 или 2) и пациентов с плохим риском (IMDC ≥ 3) соответственно [10]. В течение многих лет исследовательский ландшафт обычно включал несколько альтернативных TKI, которые также ингибируют рецепторы VEGF, включая акситиниб, кабозантиниб и ленватиниб, моноклональное антитело (MoAb), которое непосредственно ингибирует функцию VEGF (бевацизумаб) и ингибирование млекопитающего — мишени рапамицина (эверолимус) [11–15].
Ингибиторы иммунной контрольной точки (ICI) включают ингибиторы цитотоксического Т-лимфоцитарного антигена 4 (например, ипилимумаб) и против запрограммированного белка клеточной гибели 1 (PD-1) в периферических тканях (например, ниволумаб и пембролизумаб) или его лиганде (PD-L1) (например, атезолизумаб и авелумаб), некоторые из которых недавно стали предпочтительными для большинства методов лечения первой линии ПКР [16–22]. Терапия, направленная на VEGF или его рецептор (VEGF-направленные, анти-ангиогенные моноклональные антитела или TKI), обладает иммуномодулирующими эффектами, включая усиление инфильтрации иммунных клеток путем нормализации сосудистой сети опухоли, что обещает синергетическую активность [23–25]. В последние 3 года стали доступны результаты нескольких испытаний фазы III, оценивающих преимущества комбинаций ICI первой линии, включающих двойные ICI или ICI, в сочетании с VEGF-направленной терапией.
МАТЕРИАЛЫ И МЕТОДЫ
Приводим клинический случай рака почки с метастазами в легкие.
Пациентка А. Опухоль левой почки с одновременными метастазами (МТС) в легкие выявлена по данным КТ от 25.10.2019 года (с обеих сторон по всем полям множество округлых слабогиперваскулярных образований до 19 мм в диаметре несколько неоднородной структуры, с бугристыми контурами), направлена в ГАУЗ РКОД Минздрава РБ (г. Уфа), где был выставлен диагноз: Рак левой почки T3N0M1 МТС в легкие (диагноз выставлен без верификации, на основании инструментальных данных) (рис. 1). Ввиду распространенности процесса (рис. 2), ряда сопутствующих патологий от циторедуктивной нефрэктомии было решено отказаться.
Согласно клиническим рекомендациям и федеральным стандартам, а также множеству мультицентровых рандомизированных исследований 3-й фазы (таких как PISCES, COMPARZ, VEG107769 и др.), где дизайн исследований был основан на открытой оценке эффективности и безопасности пазопаниба и сунитиниба, пациентам со светлоклеточным ПКР эти препараты назначаются в качестве терапии первой линии. У пациентки произведена оценка по системе IMDC — 2 балла. Был назначен пазопаниб в стандартной дозировке 800 мг ежедневно. Больная получила 2 курса терапии 1-й линии, после чего была произведена оценка эффективности лечения, где была отмечена стабилизация заболевания. Было принято решение о продолжении терапии пазопанибом. После 5 курсов терапии была вновь произведена оценка эффективности лечения. Была выставлена прогрессия заболевания в виде появления новых очагов в легких, IMDC 2 балла.
В ходе онкологического консилиума было принято решение перевода пациентки на вторую линию терапии: ниволумаб 240 мг до прогрессии, или непереносимой токсичности, или 2 года (март 2022 г.). По август 2020 года проведено 11 курсов иммунотерапии. На контрольном обследовании по данным КТ ОГК, ОБП от 03.08.2020 отмечена положительная динамика в виде уменьшения количества и размеров очагов (множество округлых образований с четкими бугристыми контурами, максимальным размером справа до 14,7×13,6 мм; слева до 12,7×13,3 мм; в базальных отделах участки линейного фиброза. В проекции левой почки, в заднем сегменте образование с четкими бугристыми контурами, размером 37,1×38,8×54,0 мм (ранее 65×51×66 мм). Продолжена терапия ниволумабом. Проведено 31 введение. С учетом эпидемиологической обстановки по COVID-19, хорошей переносимости иммунотерапии решено увеличить дозу ниволумаба до 480 мг и увеличить интервал между введениями до 28 дней. На контрольном обследовании по данным КТ ОГК, ОБП от 31.08.2021 отмечено небольшое увеличение размеров (количество и размеры очагов в легких не увеличились; в нижней трети левой почки по задней поверхности контур почки деформирован овоидным образованием размерами 64×49×51 мм, ранее 49×40×37 мм).
В 2020 году на конгрессе ESMO был представлен результат рандомизированного исследования 3-й фазы CheckMate 9ER, где изучалась эффективность терапии ниволумаба в комбинации с ИТК кабозантинибом (рис. 3, 4) [26].
Первой точкой была ВБП, последующие: безопасность, ЧОО, ВО. Медиана наблюдения 18,1 месяца, все конечные точки были достигнуты. Комбинация достоверно увеличила выживаемость без прогрессирования (HR = 0,51, P < 0,0001; медиана 16,6), общую выживаемость (HR = 0,60; P = 0,0010) и частоту объективных ответов (P < 0 0001, 55,7 %). Полного ответа достигли 8 %. Медиана продолжительности ответа составила 20,2 мес. Нежелательные явления, требующие отмены комбинации ниволумаб + кабозантиниб, у 15,3 %.
Согласно течению заболевания, функционального статуса по шкале IMDC (12 баллов) в ходе онкологического консилиума было принято решение назначения комбинации ниволумаб + кабозантиниб off-label. С 05.10.2021 начато комбинированное лечение в рамках 3 линии терапии: ниволумаб в комбинации с кабозантинибом. На контрольном обследовании после 3 курсов терапии по данным КТ ОГК, ОБП от 11.01.2022 отмечена стабилизация заболевания (в нижней трети левой почки по задней поверхности контур почки деформирован, овоидное образование 67×55×56 мм, ранее 64×49×51 мм) (рис. 5).
Пациентка продолжила терапию ниволумабом в комбинации с кабозантинибом. На контрольном исследовании по данным КТ ОГК, ОБП от 12.05.2022 выявлено незначительное увеличение размеров образования в почке 75×60×59 мм (ранее 67×55×56 мм), согласно критериям RECIST — стабилизация заболевания. IMDC 1 балл. Пациентка продолжила терапию в прежнем режиме по 08.02.2023.
На контрольном обследовании по данным КТ от 14.02.2023 выявлена стабилизация заболевания, очаг в левой почке 76×63×61 мм (ранее 75×60×59 мм) (рис. 6), по всем легочным полям многочисленные разнокалиберные округлые образования без динамики до 12 мм.
Решено продолжить терапию в прежнем режиме: 3 курса с последующей оценкой динамики. Пациентка получила в общей сложности 64 курса ниволумаба, кабозантиниб 19 курсов. Консультирована онкоурологом, рекомендовано оперативное лечение в объеме циторедуктивной нефрэктомии слева. 05.04.2023 проведена операция: Лапароскопическая циторедуктивная нефрэктомия слева. По результатам гистологического исследования: «Светлоклеточный почечноклеточный рак почки, степень злокачественности G3 по WHO/ISUP grading system, с обширными зонами некроза. Опухоль прорастает фиброзную капсулу почки, врастает в паранефральную жировую клетчатку, не контактирует с фасцией Героты. Опухолевый тромб в почечной вене не определяется. Линии резекции свободны от опухолевого роста. В 3 исследованных лимфоузлах метастазов опухоли не определяется». Решено продолжить терапию ниволумаб + кабозантиниб.
В настоящее время пациентка получает ниволумаб (69 курсов) + кабозантиниб (ежедневно с 05.10.2022 (20 курсов)). Переносимость удовлетворительная. Нежелательных явлений, требующих коррекции дозы или отмены препарата не отмечено.
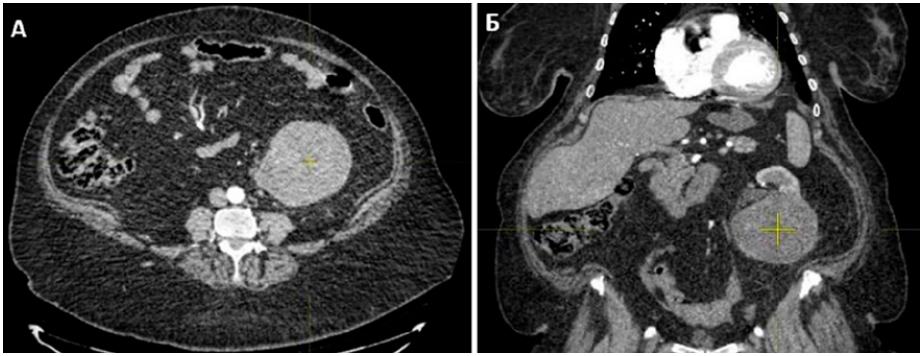
Рисунок 1. Злокачественное новообразование левой почки: А — поперечный вид; Б — продольный вид
Figure 1. Malignant neoplasm of the left kidney: A — transverse view; Б — longitudinal view
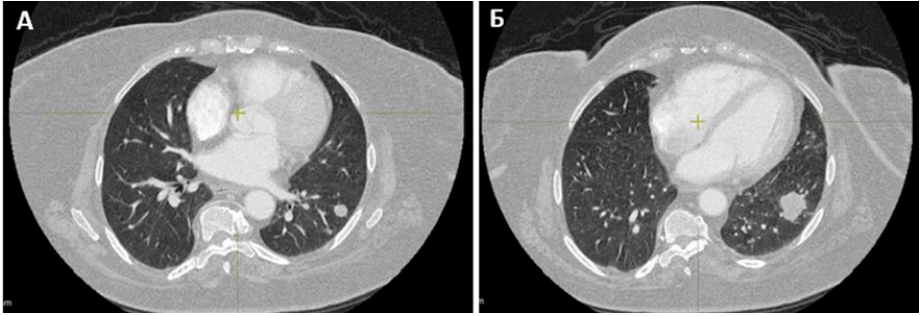
Рисунок 2. Двустороннее метастатическое поражение легких: А — вид 1; Б — вид 2
Figure 2. Bilateral metastatic lung involvement: A — view 1; Б — view 2
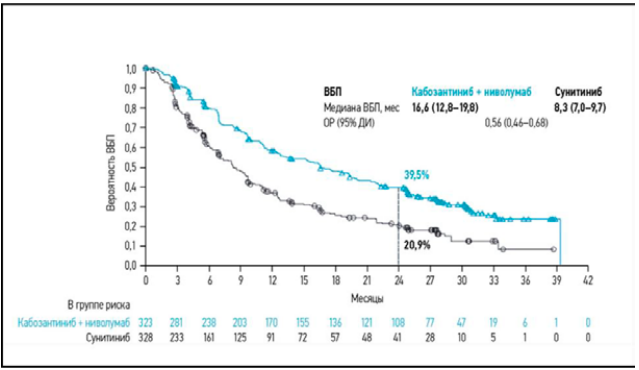
Рисунок 3. Выживаемость без прогрессирования (ВБП) в исследовании CHECKMATE-9ER по оценке независимого комитета по радиологии (медиана наблюдения 32,9 мес.).
Figure 3. Progression free survival in the CHECKMATE-9ER study as estimated by an independent radiology committee (median follow-up of 32.9 months)
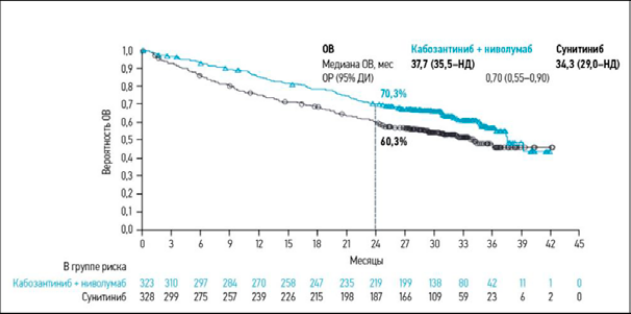
Рисунок 4. Общая выживаемость (ОВ) в исследовании CHECKMATE-9ER (медиана наблюдения 32,9 мес.)
Figure 4. Overall survival in the CHECKMATE-9ER study (median follow-up of 32.9 months)
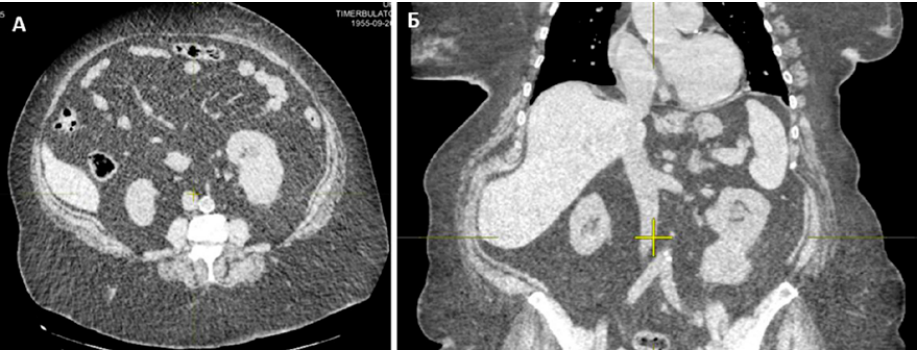
Рисунок 5. Овоидное образование левой почки: А — поперечный вид; Б — продольный вид
Figure 5. Ovoid formation in the left kidney: A — transverse view; Б — longitudinal view
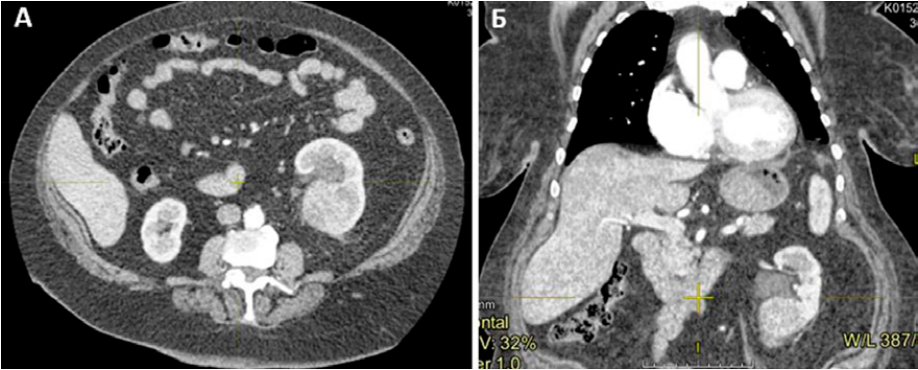
Рисунок 6. ЗНО левой почки на фоне терапии: А — поперечный вид; Б — продольный вид
Figure 6. Malignant neoplasm of the left kidney in the context of therapy: A — transverse view; Б — longitudinal view
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В 2015 году было опубликовано первое клиническое исследование CheckMate 025. В этом исследовании принял участие 821 пациент с метастатическим ПКР и прогрессированием заболевания на первой или второй линии терапии антиангиогенными препаратами. Основным критерием эффективности была общая выживаемость [19]. Затем было опубликовано исследование III фазы METEOR. Как и в исследовании CheckMate 025, включались пациенты после прогрессии на анти-VEGFR-терапии. Ниволумаб показал достоверное преимущество в отношении ОВ и ЧОО, но не в отношении ВБП. На симпозиуме GU ASCO в 2020 году авторы продемонстрировали окончательные результаты исследования CheckMate 025. Впервые у пациентов с метастатическим ПКР, получавших ингибитор контрольных точек, была проанализирована долгожданная 5‐летняя общая выживаемость, которая составила 26 %, а ее медиана — 25,8 месяца [27]. Позже эти данные были подтверждены в отечественном исследовании RENSUR5, по которому 5‐летняя общая выживаемость составила 8,2 % (медиана 11 месяцев) [28], а в американской базе SEER — 12 %.
В нашем случае пациентка не подверглась циторедуктивной нефрэктомии из-за распространенности процесса и ряда сопутствующих патологий. В связи с этим было решено начать лечение препаратом «Пазопаниб», однако после нескольких курсов терапии отмечалась прогрессия заболевания. Затем было принято решение о переводе пациентки на терапию ниволумабом во второй линии, которая также дала временную стабилизацию заболевания. Далее, опираясь на клинические исследования в off label, было предложено использование комбинированной терапии ниволумаба с кабозантинибом. Комбинация кабозантиниба и ниволумаба позволила добиться значительного снижения размеров опухоли и ингибировать ее рост. Это свидетельствует о высокой эффективности данной схемы лечения.
Рандомизированное исследование III фазы показало значительное увеличение выживаемости без прогрессирования, общей выживаемости и частоты объективных ответов у пациентов с метастатическим раком почки при использовании данной комбинации. Пациентка получала эту терапию и продемонстрировала стабильное состояние заболевания, что подтверждается результатами контрольных обследований по данным КТ ОГК, ОБП.
Также отмечено улучшение общего самочувствия, снижение болевого синдрома и улучшение качества жизни. Наблюдаемые побочные эффекты были в целом хорошо контролируемы и не приводили к преждевременному прекращению лечения.
Интересно отметить, что пациентка продолжает получать комбинированную терапию и показывает удовлетворительную переносимость без значимых нежелательных явлений, требующих коррекции дозы или отмены препарата. Пациентка также прошла лапароскопическую циторедуктивную нефрэктомию, которая ранее была невозможна ввиду распространенности процесса.
ЗАКЛЮЧЕНИЕ
Таким образом, комбинированное применение кабозантиниба и ниволумаба является перспективной стратегией лечения ПКР. Кабозантиниб выполняет роль ингибитора ростового фактора рецептора эпидермального ростового фактора, что препятствует прогрессированию опухоли. Ниволумаб, в свою очередь, является ингибитором рецептора PDL-1, который повышает активность иммунной системы и способствует разрушению опухолевых клеток.
В данном клиническом случае описана эффективность комбинации химиоиммунной терапии у предлеченных пациентов с ПКР. У пациентки появилась возможность проведения циторедуктивной нефрэктомии с сохранением качества жизни.
Список литературы
1. Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–49. DOI: 10.3322/caac.21660
2. Padala S.A., Barsouk A., Thandra K.C., Saginala K., Mohammed A., Vakiti A., et al. Epidemiology of renal cell carcinoma. World J Oncol. 2020;11(3):79–87. DOI: 10.14740/wjon1279
3. Jonasch E., Walker C.L., Rathmell W.K. Clear cell renal cell carcinoma ontogeny and mechanisms of lethality. Nat Rev Nephrol. 2021;17(4):245–61. DOI: 10.1038/s41581-020-00359-2
4. Heng D.Y., Xie W., Regan M.M., Harshman L.C., Bjarnason G.A., Vaishampayan U.N., et al. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol. 2013;14(2):141–8. DOI: 10.1016/S1470-2045(12)70559-4
5. Jacobsen J., Grankvist K., Rasmuson T., Bergh A., Landberg G., Ljungberg B. Expression of vascular endothelial growth factor protein in human renal cell carcinoma. BJU Int. 2004;93(3):297–302. DOI: 10.1111/j.1464-410x.2004.04605.x
6. Rini B.I. Vascular endothelial growth factor-targeted therapy in renal cell carcinoma: current status and future directions. Clin Cancer Res. 2007;13(4):1098–106. DOI: 10.1158/1078-0432.CCR-06-1989
7. Kaelin W.G. Jr. The von Hippel-Lindau tumor suppressor protein and clear cell renal carcinoma. Clin Cancer Res. 2007;13(2 Pt 2):680s–4s. DOI: 10.1158/1078-0432.CCR-06-1865
8. Rassy E., Flippot R., Albiges L. Tyrosine kinase inhibitors and immunotherapy combinations in renal cell carcinoma. Ther Adv Med Oncol. 2020;12:1758835920907504. DOI: 10.1177/1758835920907504
9. Moran M., Nickens D., Adcock K., Bennetts M., Desscan A., Charnley N., et al. Sunitinib for metastatic renal cell carcinoma: a systematic review and meta-analysis of real-world and clinical trials data. Target Oncol. 2019;14(4):405–16. DOI: 10.1007/s11523-019-00653-5
10. Escudier B., Porta C., Schmidinger M., Rioux-Leclercq N., Bex A., Khoo V., et al. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2019;30(5):706–20. DOI: 10.1093/annonc/mdz056
11. Suyama K., Iwase H. Lenvatinib: a promising molecular targeted agent for multiple cancers. Cancer Control. 2018;25(1):1073274818789361. DOI: 10.1177/1073274818789361
12. Vecchio S.J.D., Ellis R.J. Cabozantinib for the management of metastatic clear cell renal cell carcinoma. J Kidney Cancer VHL. 2018;5(4):1–5. DOI: 10.15586/jkcvhl.2018.109
13. Bellesoeur A., Carton E., Alexandre J., Goldwasser F., Huillard O. Axitinib in the treatment of renal cell carcinoma: design, development, and place in therapy. Drug Des Devel Ther. 2017;11:2801–11. DOI: 10.2147/DDDT.S109640
14. Garcia J., Hurwitz H.I., Sandler A.B., Miles D., Coleman R.L., Deurloo R., et al. Bevacizumab (Avastin®) in cancer treatment: A review of years of clinical experience and future outlook. Cancer Treat Rev. 2020;86:102017. DOI: 10.1016/j.ctrv.2020.102017
15. Meskawi M., Valdivieso R., Dell’Oglio P., Trudeau V., Larcher A., Karakiewicz P.I. The role of everolimus in renal cell carcinoma. J Kidney Cancer VHL. 2015;2(4):187–94. DOI: 10.15586/jkcvhl.2015.43
16. Brown L.C., Desai K., Zhang T., Ornstein M.C. The Immunotherapy landscape in renal cell carcinoma. BioDrugs. 2020;34(6):733–48. DOI: 10.1007/s40259-020-00449-4
17. Aggen D.H., Drake C.G., Rini B.I. Targeting PD-1 or PD-L1 in metastatic kidney cancer: combination therapy in the first-line setting. Clin Cancer Res. 2020;26(9):2087–95. DOI: 10.1158/1078-0432.CCR-19-3323
18. Motzer R.J., Escudier B., McDermott D.F., George S., Hammers H.J., Srinivas S., et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015;373(19):1803–13. DOI: 10.1056/NEJMoa1510665
19. McDermott D.F., Huseni M.A., Atkins M.B., Motzer R.J., Rini B.I., Escudier B., et al. Clinical activity and molecular correlates of response to atezolizumab alone or in combination with bevacizumab versus sunitinib in renal cell carcinoma. Nat Med. 2018 Jun;24(6):749–57. DOI: 10.1038/s41591-018-0053-3
20. Motzer R.J., Rini B.I., McDermott D.F., Redman B.G., Kuzel T.M., Harrison M.R., et al. Nivolumab for metastatic renal cell carcinoma: results of a randomized phase II trial. J Clin Oncol. 2015;33(13):1430–7. DOI: 10.1200/JCO.2014.59.0703
21. Motzer R.J., Jonasch E., Boyle S., Carlo M.I., Manley B., Agarwal N., et al. NCCN Guidelines insights: kidney cancer, version 1.2021. J Natl Compr Canc Netw. 2020;18(9):1160–70. DOI: 10.6004/jnccn.2020.0043
22. Tenold M., Ravi P., Kumar M., Bowman A., Hammers H., Choueiri T.K., et al. Current approaches to the treatment of advanced or metastatic renal cell carcinoma. Am Soc Clin Oncol Educ Book. 2020;40:1–10. DOI: 10.1200/EDBK_279881
23. Roland C.L., Lynn K.D., Toombs J.E., Dineen S.P., Udugamasooriya D.G., Brekken R.A. Cytokine levels correlate with immune cell infiltration after anti-VEGF therapy in preclinical mouse models of breast cancer. PLoS One. 2009;4(11):e7669. DOI: 10.1371/journal.pone.0007669
24. Furukawa K., Nagano T., Tachihara M., Yamamoto M., Nishimura Y. Interaction between immunotherapy and antiangiogenic therapy for cancer. Molecules. 2020;25(17):3900. DOI: 10.3390/molecules25173900
25. Lee W.S., Yang H., Chon H.J., Kim C. Combination of anti-angiogenic therapy and immune checkpoint blockade normalizes vascularimmune crosstalk to potentiate cancer immunity. Exp Mol Med. 2020;52(9):1475–85. DOI: 10.1038/s12276-020-00500-y
26. Choueiri T., Powles M., Burotto M., Bourlon M.T., Zurawski B., Oyervides Juárez V.M., et al. 696O_PR Nivolumab + cabozantinib vs sunitinib in first‐line treatment for advanced renal cell carcinoma: First results from the randomized phase III CheckMate 9ER trial. Ann Oncol. 2020;31(suppl_4):S1142–215. DOI: 10.1016/j.annonc.2020.08.2257
27. Motzer R., Tykodi S., Escudier B., Oudard S., Hammers H.J., McDermott D.F., et al. Final analysis of the CheckMate 025 trial comparing nivolumab (NIVO) versus everolimus (EVE) with >5 years of follow‐up in patients with advanced renal cell carcinoma (aRCC). J Clin Oncol. 2020;38 (suppl 6; abstr 617). DOI: 10.1200/JCO.2020.38.6_suppl.617
28. Tsimafeyeu I., Zolotareva T., Varlamov S., Zukov R., Petkau V., Mazhbich M., et al. Five-year survival of patients with metastatic renal cell carcinoma in the Russian Federation: results from the RENSUR5 Registry. Clin Genitourin Cancer. 2017;15(6):e1069–72. DOI: 10.1016/j.clgc.2017.07.017
Об авторах
В. Е. АскаровРоссия
Аскаров Вадим Евгеньевич — отделение дневного стационара противоопухолевой терапии
Республика Башкортостан, Уфа
А. В. Султанбаев
Россия
Султанбаев Александр Валерьевич — к.м.н., отдел противоопухолевой лекарственной терапии
Республика Башкортостан, Уфа
К. В. Меньшиков
Россия
Меньшиков Константин Викторович — к.м.н., доцент, кафедра онкологии и клинической морфологии, отдел химиотерапии
Республика Башкортостан, УфаШ. И. Мусин
Россия
Мусин Шамиль Исмагилович — к.м.н., хирургическое отделение № 6
Республика Башкортостан, Уфа
Н. И. Султанбаева
Россия
Султанбаева Надежда Ивановна — отделение противоопухолевой лекарственной терапии № 1
Республика Башкортостан, Уфа
Е. В. Попова
Россия
Попова Екатерина Владимировна — амбулаторное отделение противоопухолевой лекарственной терапии (химиотерапии)
Республика Башкортостан, Уфа
И. А. Меньшикова
Россия
Меньшикова Ирина Асхатовна — к.м.н., доцент, кафедра биологической химии
Республика Башкортостан, Уфа
Рецензия
Для цитирования:
Аскаров В.Е., Султанбаев А.В., Меньшиков К.В., Мусин Ш.И., Султанбаева Н.И., Попова Е.В., Меньшикова И.А. Комбинированное применение кабозантиниба и ниволумаба в клинической практике. Креативная хирургия и онкология. 2024;14(1):94-100. https://doi.org/10.24060/2076-3093-2024-14-1-94-100
For citation:
Askarov V.E., Sultanbaev A.V., Menshikov K.V., Musin Sh.I., Sultanbaeva N.I., Popova E.V., Menshikova I.A. Combined Use of Cabozantinib and Nivolumab in Clinical Practice. Creative surgery and oncology. 2024;14(1):94-100. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-1-94-100


































