Перейти к:
Метастатическое поражение позвоночника с минимальной эпидуральной компрессией: хирургическое лечение или стереотаксическая лучевая терапия?
https://doi.org/10.24060/2076-3093-2024-14-2-127-135
Аннотация
Введение. Выбор метода лечения между экстракраниальной стереотаксической лучевой терапией и хирургией метастатической опухоли тела позвонка с минимальным эпидуральным распространением или без эпидуральной компрессии твердой мозговой оболочки в настоящее время четко не определен. Материалы и методы. В исследование включен 41 пациент, получивший лечение в ФГБУ «НМИЦ онкологии» Минздрава России с 01.01.2014 по 31.12.2022. Критерием включения в исследование явилось наличие метастатической опухоли позвонка при условии отсутствия или с наличием минимальной эпидуральной компрессии твердой мозговой оболочки и области корешковой воронки (ESCC 0–1b). Больные были разделены на две группы: 21 пациент (группа SBRT) получил только экстракраниальную стереотаксическую лучевую терапию и 20 больных, которым проведено хирургическое вмешательство с последующей адъювантной экстракраниальной стереотаксической лучевой терапией через 1 месяц после операции (Oр. + Аd.SBRT). Результаты. В раннем послеоперационном периоде в группе SBRT не отмечалось ухудшения неврологического статуса больных, не отмечено улучшения функционального состояния по шкале Карновского и регресса болевого синдрома в отличие от больных группы Oр. + Аd.SBRT. Продолженный рост в группе SBRT возник у 3 (21%) пациентов, в группе Oр. + Аd.SBRT — только у 1 пациента (6%) через 1 месяц после операции. Обсуждение. В группе Oр. + Аd.SBRT в раннем послеоперационном периоде отмечалось улучшение функционального статуса, регресс болевого синдрома носил значимо более выраженный характер, чем у больных группы SBRT, что можно объяснить прямой декомпрессией сдавленного спинномозгового корешка и ликвидацией нарастающей нестабильности позвоночного столба. Заключение. У пациентов с метастатическим поражением позвоночника с минимальным эпидуральным распространением без эпидуральной компрессии спинного мозга при выраженном болевом синдроме и признаках нарастающей нестабильности позвоночного столба хирургическое лечение, дополненное адъювантной экстракраниальной стереотаксической лучевой терапией, является предпочтительным методом лечения.
Ключевые слова
Для цитирования:
Кит О.И., Закондырин Д.Е., Гринь А.А., Росторгуев Э.Е., Пржедецкий Ю.В., Сакун П.Г., Вошедский В.И., Матевосян Б.В., Шепеля Т.С. Метастатическое поражение позвоночника с минимальной эпидуральной компрессией: хирургическое лечение или стереотаксическая лучевая терапия? Креативная хирургия и онкология. 2024;14(2):127-135. https://doi.org/10.24060/2076-3093-2024-14-2-127-135
For citation:
Kit O.I., Zakondyrin D.E., Grin A.A., Rostorguev E.E., Przhedetskiy Y.V., Sakun P.G., Voshedskii V.I., Matevosian B.V., Shepelya T.S. Metastatic Spinal Lesion with Minimal Epidural Compression: Surgical Treatment or Stereotactic Radiotherapy? Creative surgery and oncology. 2024;14(2):127-135. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-127-135
ВВЕДЕНИЕ
Исследования показывают, что почти у 70 % пациентов с наиболее распространенными злокачественными новообразованиями (рак молочной железы, легких, предстательной железы) выявляются метастазы в костную ткань, в том числе и в позвоночный столб. Нередко метастатическое поражение тел позвонков осложняется эпидуральной компрессией спинного мозга (epidural spinal cord compression, или ESCC) и явлениями нестабильности пораженного позвоночно-двигательного сегмента [1].
M. Н. Bilsky с соавт. [2] предложили шкалу степени эпидуральной компрессии, имеющую 6 градаций и получившую всеобщее признание: стадия 0 — поражение только кости, стадия 1а — распространение в эпидуральное пространство без деформации дурального мешка, стадия 1b — деформация дурального мешка без признаков воздействия на спинной мозг, стадия 1c — деформация дурального мешка с признаками воздействия на спинной мозг, стадия 2 — компрессия спинного мозга с сохранением резервных ликворных пространств, стадия 3 — компрессия спинного мозга без сохранения ликворных пространств. H. Uei и cоавт. [3] не выявили наличия корреляции между степенью эпидуральной компрессии и выраженностью двигательных расстройств, но авторы пришли к выводу, что при выраженной компрессии (2–3-я степень) риск развития парезов выше.
Шкала Spinal Instability Neoplastic score (SINS) была предложена для прогнозирования нестабильности при опухолевом поражении позвоночника в 2010 г. Spine Oncology Study Group (SOSG) [4] и включает 6 факторов: локализацию опухоли в позвоночнике, тип новообразования, наличие деформации позвоночника, cтепень коллапса тела позвонка, вовлеченность задних элементов. По результатам анализа клинического случая больной получает по шкале от 0 до 18 баллов. Участники SOSG определили критерии использования шкалы: от 0 до 6 баллов — позвоночный столб стабилен, от 7 до 12 баллов — нарастающая нестабильность, с 13 до 18 баллов — явная нестабильность. Группа пациентов, имеющих 7–12 баллов по SINS, является самой сложной для выбора тактики лечения, поскольку различные комбинации индивидуальных факторов могут давать такие значения по указанной шкале, при этом это самая частая клиническая ситуация [5].
Декомпрессивно-стабилизирующие вмешательства обеспечивают локальный контроль за распространением опухоли, декомпрессию невральных структур и ликвидацию нестабильности позвоночного столба. Польза хирургической декомпрессии при развившихся явлениях выраженной эпидуральной компрессии спинного мозга опухолью кажется очевидной, однако, по данным Maseda M. и cоавт. [6], отсутствует статистически значимая разница в риске прогрессирования пареза в группах больных, которым выполнялись декомпрессивно-стабилизирующие и стабилизирующие (без декомпрессии) вмешательства и даже лучевая терапия без операции. В течение длительного времени в лечении данной группы больных и при отсутствии выраженной эпидуральной компрессии спинного мозга применялась конвенциальная лучевая терапия, которая в настоящее время вытесняется конформными методами лучевой терапии, среди которых стереотаксическая лучевая терапия и радиохирургия заняли ведущие позиции.
I. Laufer и cоавт. [7] был разработан популярный среди онкологов алгоритм выбора тактики лечения метастазов в позвоночник (комбинация конвенциальной терапии или стереотаксической лучевой терапии и хирургического лечения) в зависимости от неврологических проявлений (N — neurological assessment), природы первичной опухоли (О — oncological assessment), наличия нестабильности позвоночника (M — mechanical assessment) и распространенности онкологического процесса (S — systematic assessment), получивший название NOMS. Очевидными минусами алгоритма являются необходимость понимания радиочувствительности первичной опухоли и сложность в принятии решения при показателях нестабильности в пределах от 7 до 12 баллов по шкале SINS.
Таким образом, в доступной литературе отсутствуют четкие критерии для выбора между стереотаксической лучевой терапией или хирургическим методом лечения с последующим адъювантным лучевым лечением у пациентов с минимальным эпидуральным распространением метастатической опухоли тела позвонка без эпидуральной компрессии твердой мозговой оболочки.
Целью исследования был анализ результатов лечения у пациентов при минимальной эпидуральной компрессии твердой мозговой оболочки с использованием только экстракраниальной стереотаксической лучевой терапии или хирургического метода лечения, дополненного адъювантной экстракраниальной стереотаксической лучевой терапией.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включен 41 пациент, получивший лечение в ФГБУ «НМИЦ онкологии» Минздрава России с 01.01.2014 по 31.12.2022. Критерием включения в исследование явилось наличие метастатической опухоли позвонка при условии отсутствия или с минимальной эпидуральной компрессией твердой мозговой оболочки (ESCC 0–1b).
Больные были разделены на две группы: 21 пациенту (группа SBRT) проведена экстракраниальная стереотаксическая лучевая терапия в режиме радиохирургии или режиме гипофракционирования; 20 больным проведено декомпрессивное или декомпрессивно-стабилизирующее вмешательство в связи с латеральной компрессией и болевым корешковым синдромом с последующей адъювантной экстракраниальной стереотаксической лучевой терапией через 1 месяц после операции (группа Oр. + Аd.SBRT).
В работе соблюдались этические принципы, предъявляемые Хельсинкской декларацией Всемирной медицинской ассоциации (World Medical Association Declaration of Helsinki, 1964, ред. 2013). Исследование одобрено Комитетом по биомедицинской этике при ФГБУ «НМИЦ онкологии» Минздрава России (выписка из протокола заседания № 118 от 02.06.2022). Информированное согласие получено от всех участников исследования.
Всем пациентам при поступлении выполняли компьютерную томографию органов грудной клетки, брюшной полости и малого таза, а также магнитно-резонансную томографию пораженного отдела позвоночного столба. Для оценки неврологического статуса и состояния пациентов использовали шкалы Frankel и Karnofsky в день поступления и через 1 месяц после завершения курса лучевой терапии или операции с последующей адъювантной лучевой терапией. Интенсивность болевого синдрома оценивали по шкале ВАШ, выраженность опухолевой нестабильности позвоночника по шкале SINS.
В группе SBRT экстракраниальная стереотаксическая лучевая терапия проведена на линейном ускорителе Novalis Tx, Varian, в режиме радиохирургии (SRS; за 1 фракцию) и режиме гипофракционирования (РОД 5 Гр, СОД 25 Гр, 5 фракций) она была использована как основной метод лечения (рис. 1). Общий объем опухоли (GTV) в среднем составлял 20,4 ± 4,6 см². Средняя доза облучения при однофракционных курсах составила 16 Гр. При применении методики гипофракционирования средняя суммарная очаговая доза (СОД) составила 25 (от 24 до 26) Гр, средняя разовая очаговая доза (РОД) — 5,2 Гр (от 5 до 8). Облучение проводилось на линейном ускорителе Novalis Tx, Varian.
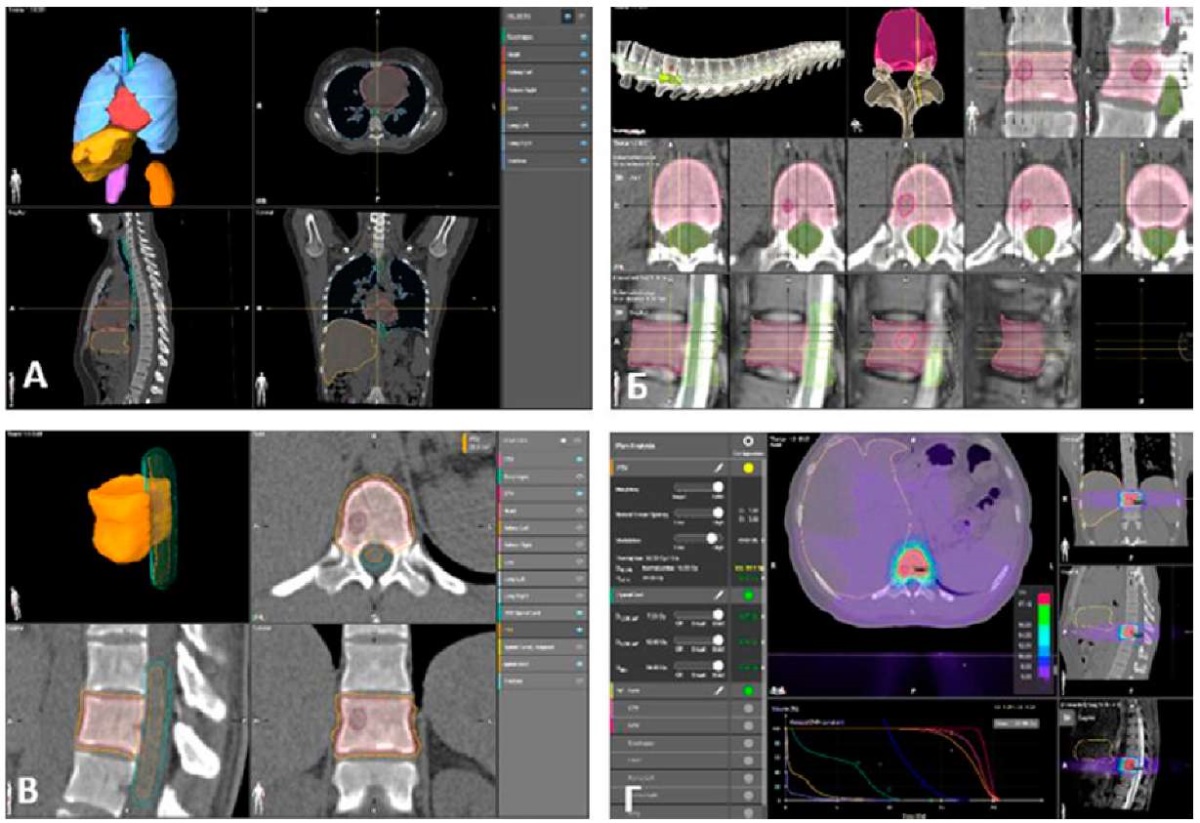
Рисунок 1. Планирование облучения: а — анатомическая сегментация и оконтуривание критических органов и структур; б — оконтуривание объема GTV по изображениям различных модальностей и формирование объема CTV; в — оконтуривание спинного мозга и формирование объема PTV; г — дозиметрическое планирование с контролем покрытия мишени и нагрузки на критические органы и структуры с последующим анализом рассчитанного плана облучения
Figure 1. Radiation treatment planning: а — anatomical segmentation and delineation of critical organs and structures; б — delineation of the GTV according to images of various modalities and determining the CTV; в — delineation of the spinal cord and determining the PTV; г — radiation dosage planning with control of target coverage and load on critical organs and structures, followed by analysis of the calculated radiation treatment planning
Предварительно выполнялась топометрическая томография на компьютерном томографе Siemens Somatom, обработка предварительной топометрии проходила на станции виртуальной симуляции Singo Via. Для иммобилизации и воспроизводимости при укладке пациента использовался вакуумный матрас для всего тела с бордом ArmShuttle. С помощью программного обеспечения Elements Brainlab производилось сегментирование, оконтуривание и формирование 3D-плана лечения для линейного ускорителя. Укладка и контроль положения пациента выполнялись по ортогональным рентгеновским снимкам с помощью системы позиционирования ExacTrac X-Ray Monitoring BrainLab. Верификация рассчитанного плана стереотаксического радиотерапевтического лечения проводилась на фантоме StereoPHAN с матрицей детекторов SRS Mapcheck. Перед сеансом радиохирургического лечения выполнялась проверка калибровки ускорителя по абсолютной дозе и проверка калибровки системы позиционирования. Доставка дозы осуществлялась с использованием динамической объемно-модулированной методики (VMAT). Клинический объем опухоли (СTV) определялся в соответствии с International Spine Radiosurgery Consortium Consensus Guidelines [5]. Планируемый объем опухоли (PTV) вычислялся путем добавления 2-мм края к границам CTV с вычетом объема PRV (planning risk volume) для спинного мозга (+3 мм к краю спинного мозга во всех направлениях) и учетом расположения органов риска (ротоглотки, пищевода и т. д.) (рис. 1).
Хирургическое лечение, выполненное 20 (49 %) больным в группе Oр. + Аd.SBRT, включало один из двух типов вмешательств: декомпрессивное вмешательство — 12 (60 %) случаев, декомпрессивно-стабилизирующее вмешательство с транспедикулярной биопсией опухоли тела позвонка — 8 (40 %) случаев. Выбор характера оперативного вмешательства в связи с латеральной компрессией корешковой воронки во всех случаях оставался за хирургом. В данной группе адъювантная экстракраниальная стереотаксическая лучевая терапия на область операции была проведена на линейном ускорителе Novalis Tx, Varian со средними значения РОД 2,8 (от 2,3 до 3,5) Гр и СОД 40 (от 40 до 45) Гр через 1 месяц после операции.
Клиническая характеристика групп представлена в таблице 1.
Признак | SBRT, n = 21 | Oр. + Аd.SBRT, n = 20 | P |
Возраст, лет М ± m | 55,9 ± 2,2 | 56,7 ± 2,8 | >0,05 |
Пол мужской | 3 (14 %) | 9 (45 %) | <0,05* |
женский | 18 (86 %) | 11 (55 %) | |
Гистология первичной опухоли: | |||
рак легкого | 3 (14 %) | 5 (25 %) | — |
рак молочной железы | 15 (71 %) | 3 (15 %) | |
рак почки | 0 | 2 (10 %) | |
рак предстательной железы | 1 (5 %) | 0 | |
рак шейки матки | 0 | 1 (5 %) | |
рак яичников | 0 | 1 (5 %) | |
рак мочевого пузыря | 0 | 2 (15 %) | |
меланома кожи | 1 (5 %) | 1 (5 %) | |
рак печени | 0 | 1 (5 %) | |
гемобластозы | 0 | 2 (10 %) | |
БВПО | 1 (5 %) | 2 (10 %) | |
Уровень поражения: Шейный | 3 (14 %) | 2 (10 %) | — |
Грудной | 9 (43 %) | 4 (20 %) | |
Поясничный | 7 (34 %) | 14 (70 %) | |
Крестцовый | 2 (9 %) | 0 | |
Степень эпидуральной компрессии: | |||
0 | 19 (90 %) | 5 (25 %) | <0,05* |
1а | 0 | 2 (10 %) | |
1b | 2 (10 %) | 13 (65 %) в т. ч. сдавление корешка у 6 (30 %) | |
Нестабильность по SINS, баллы М ± m | 4,5 ± 0,4 | 7,1 ± 0,48 | <0,05* |
Неврологический статус по шкале Frankel | |||
Е | 21 (100 %) | 18 (90 %) | >0,05 |
D | 0 | 2 (10 %) | |
Функциональный статус по шкале Karnofsky, баллы Me [Q1; Q3] | 70 [ от 70 до 80] | 70 [70] | >0,05 |
ВАШ, баллы Me [Q1; Q3] | 5 [ от 3 до 7] | 7 [от 6 до 8] | >0,05 |
Таблица 1. Клиническая характеристики групп пациентов
Table 1. Clinical characteristics of patient groups
Примечание: * выявлены статистически значимые различия между группами.
Note: * statistically significant differences between groups were revealed.
Группа SBRT оценивалась в день поступления и на 30 сутки после лучевого лечения, группа Oр. + Аd.SBRT оценивалась в день поступления и на 60 сутки после хирургического лечения и проведения адъювантной лучевой терапии (30 сутки после операции). Анализ продолженного роста опухоли осуществлялся каждые 3 месяца после завершения курса экстракраниальной стереотаксической лучевой терапии или адъювантной экстракраниальной стереотаксической лучевой терапии на область операции.
Послеоперационная оценка локального контроля осуществлялась с использованием МРТ и ПЭТ-КТ с 18F-фтордезоксиглюкозой (18-ФДГ). Функциональный статус оценивался по шкале Карновского, болевой синдром — по визуально-аналоговой шкале боли. Необходимые данные пациентов фиксировались в электронной базе Microsoft Excel, после чего проводили анализ данных в программе Statistica 7.0. Для каждой группы показателей определяли тип распределения данных (построение гистограмм по критерию согласия Колмогорова — Смирнова). Если применение критерия показывало нормальное распределение данных, для описания использовалось среднее, ошибка среднего (М ± m). При отличии распределения от нормального закона для описания использовались значения медианы, 1-го и 3-го квартилей (Me [Q1; Q3]), а при дальнейшем сравнении групп — методы непараметрической статистики. При сравнении двух независимых групп использовался критерий Манна — Уитни, при сравнении связанных переменных — тест Уилкоксона. Пороговый уровень значимости при проверке статистических гипотез принимался равным 0,05.
РЕЗУЛЬТАТЫ
После проведенного сопоставления групп пациентов по изучаемым признакам выявлены статистически значимые различия по типу эпидурального распространения метастатической опухоли с формированием латерального стеноза канала и степени нестабильности пораженного позвоночно-двигательного сегмента. Оба показателя достоверно преобладали в группе Oр. + Аd.SBRT (табл. 2, 3).
Признак | До экстракраниальной стереотаксической лучевой терапии | После экстракраниальной стереотаксической лучевой терапии | P |
Неврологический статус по шкале Frankel | |||
Е | 21 (100 %) | 21 (100 %) | — |
D | 0 | 0 | |
С | 0 | 0 | |
Функциональный статус по шкале Karnofsky, баллы Me [Q1; Q3] | 70 [ 70; 80] | 70 [ 70; 80] | >0,05 |
ВАШ, баллы Me [Q1; Q3] | 5 [ 3,5; 7,5] | 4 [ 1,5; 4,5] | <0,05* |
Динамика болевого синдрома по ВАШ | |||
уменьшение болей | 9 ( %) | — | |
без динамики | 11 ( %) | ||
усиление болей | 1 ( %) | ||
Таблица 2. Ближайшие исходы в группе SBRT (оценка через 30 дней)
Table 2. Short-term outcomes in the SBRT group (evaluation after 30 days)
Примечание: * выявлены статистически значимые различия.
Note: * statistically significant differences were revealed.
Признак | До операции | После адъювантной экстракраниальной стереотаксической лучевой терапии | P |
Неврологический статус по шкале Frankel после операции | |||
Е | 18 (90 %) | 16 (80 %) | — |
D | 2 (10 %) | 3 (15 %) | |
С | 0 | 1 (5 %) | |
Функциональный статус по шкале Karnofsky после операции, баллы M ± m | 70 [ 70; 80] | 80 [ 70; 80] | <0,05* |
ВАШ, баллы Me [Q1; Q3] | 7 [ 6; 7,5] | 3 [ 2; 3] | <0,05* |
Динамика болевого синдрома по ВАШ | |||
уменьшение болей | 17 (%) | — | |
без динамики | 3 (%) | ||
усиление болей | 0 | ||
Таблица 3. Ближайшие исходы в группе Oр. + Аd.SBRT (оценка через 60 дней)
Table 3. Short-term outcomes in the Op+Аd.SBRT group (evaluation after 60 days)
Примечание: * выявлены статистически значимые различия.
Note: * statistically significant differences were revealed.
Катамнез на момент написания статьи прослежен у 30 (73 %) пациентов в период от 2,2 до 43 месяцев, у 14 (67 %) больных в группе SBRT и 16 (80 %) — в группе Oр. + Аd.SBRT. Все больные проходили комбинированное или комплексное лечение. Продолженный рост в течение периода наблюдения в группе SBRT возник у 3 (21 %) пациентов, продолжительность безрецидивного периода составила в среднем 11,4 ± 6,6 месяца. В группе Oр. + Аd.SBRT продолженный рост за период наблюдения отмечен только у 1 (6 %) пациента через 0,9 месяца после операции. Прогрессирование основного заболевания отмечалось у 8 (57 %) пациентов из группы SBRT и 7 (44 %) — из группы Oр. + Аd.SBRT. Выживаемость до прогрессирования составила в среднем 7,7 ± 2,2 и 10,2 ± 2,3 месяца соответственно.
ОБСУЖДЕНИЕ
Анализ ближайших результатов в различных группах выявил следующие закономерности. В группе SBRT не отмечалось ухудшения неврологического статуса больных, не отмечалось улучшения функционального состояния по шкале Карновского, не отмечено существенного регресса болевого синдрома (в среднем не более чем на 1 балл по ВАШ — рис. 2 а). В данной группе у одного пациента отмечалось даже нарастание выраженности болей после облучения, что соответствует данным литературы, согласно которым регресс болевого синдрома после стереотаксической лучевой терапии наблюдается у до 60–70 % больных в течение 0.8–1,8 месяца, а значительное усиление болевого синдрома (чаще всего уже в первые дни после облучения) (pain flare) — у 5,7–15 % пациентов [8–10].
В группе Oр. + Аd.SBRT при 1b степени компрессии по ECSS у 6 (30 %) больных отмечалось сдавление спинномозгового корешка с соответствующей неврологической симптоматикой. У 70 % пациентов отмечена нестабильность по SINS выше 7 баллов, что и определяло наш выбор в пользу хирургического лечения. В данной группе в раннем послеоперационном периоде отмечалось улучшение функционального статуса, но наблюдались редкие осложнения в виде временного неврологического дефицита у пациентов с нормальным неврологическим статусом до оперативного вмешательства (10 %). В данной группе регресс болевого синдрома носил значимо более выраженный характер, чем у больных группы SBRT (рис. 2 б), что можно объяснить прямой декомпрессией сдавленного спинномозгового корешка и ликвидацией нарастающей нестабильности позвоночного столба.
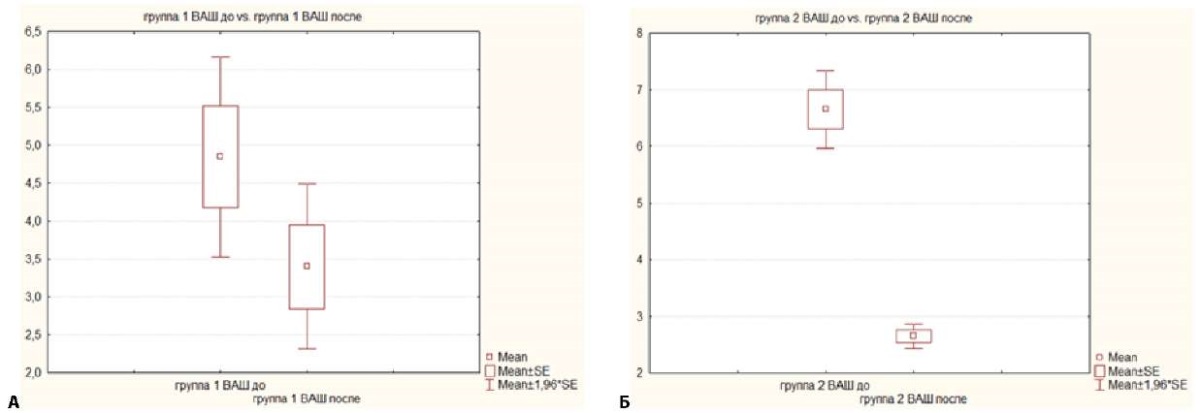
Рисунок 2. Уровень боли по визуально-аналоговой шкале в группах пациентов до и после этапов лечения: А — в группе SBRT, Б — в группе Oр. + Аd.SBRT
Figure 2. Pain level according to the Visual Analogue Scale in the groups of patients before and after the treatment stages: А — in the SBRT group, Б — in the Or+Аd.SBRT group
Анализ временного интервала до продолженного роста опухоли представлял больший интерес, чем выживаемость без прогрессирования, определявшаяся химио- и радиочувствительностью первичной опухоли, а не методом локального лечения метастатического поражения позвоночника.
В группе SBRT продолженный рост опухоли отмечен в среднем на 11,4 ± 6,6 месяца, что больше средних литературных значений (от 5,9 до 6,8 месяца) [11–13]. Это, вероятно, может быть обусловлено преобладанием в группе SBRT пациентов с нулевой степенью эпидуральной компресcии по ECSS; возможно, малым количеством наблюдений. Нами также не отмечено токсического действия облучения в виде отсроченных компрессионных переломов тел позвонков (vertebral compression fracture, или VCF), частота которых по данным тех же авторов в течение 1 года может достигать 4.8–9,1 %. В группе Oр. + Аd.SBRT продолженный рост опухоли за период наблюдения обнаружен только у одного больного — 5 % случаев.
ЗАКЛЮЧЕНИЕ
У пациентов с метастатическим поражением позвоночника без эпидуральной компрессии спинного мозга при выраженном болевом синдроме и признаках нарастающей нестабильности позвоночного столба хирургическое лечение, дополненное адъювантной экстракраниальной стереотаксической лучевой терапией, является предпочтительным методом лечения.
Список литературы
1. Кит О.И., Закондырин Д.Е., Гринь А.А., Росторгуев Э.Е., Юндин С.В. Опыт лечения опухолей позвоночника, осложненных компрессией спинного мозга и его корешков. Инновационная медицина Кубани. 2022;1:5–11. DOI: 10.35401/2500-0268-2022-25-1-5-11
2. Кит О.И., Вошедский В.И., Сакун П.Г., Гусарева М.А., Власов С.Г., Мусейко К.Н. и др. Опыт применения радиохирургического комплекса Novalis Tx в практике ФГБУ «НМИЦ онкологии» Минздрава России. Южно-Российский онкологический журнал. 2020;1(4):32–7. DOI: 10.37748/2687-0533-2020-1-4-4
3. Bilsky M.H., Laufer I., Fourney D.R., Groff M., Schmidt M.H., Varga P.P., et al. Reliability analysis of the epidural spinal cord compression scale. J Neurosurg Spine. 2010;13(3):324–8. DOI: 10.3171/2010.3.SPINE09459
4. Uei H., Tokuhashi Y., Maseda M., Nakahashi M., Sawada H., Nakayama E., et al. Comparison between minimally invasive spine stabilization with and without posterior decompression for the management of spinal metastases: a retrospective cohort study. J Orthop Surg Res. 2018;13(1):87. DOI: 10.1186/s13018-018-0777-2
5. Fisher C.G., DiPaola C.P., Ryken T.C. A novel classification system for spinal instability in neoplastic disease: an evidencebased approach and expert consensus from the Spine. Spine (Phila Pa 1976). 2010;35:E1221–9. DOI: 10.1097/BRS.0b013e3181e16ae2
6. Pennington Z., Ahmed A.K., Westbroek E.M., Cottrill E., Lubelski D., Goodwin M.L., et al. SINS Score and Stability: evaluating the need for stabilization within the uncertain category. World Neurosurg. 2019;128;1034–47. DOI: 10.1016/j.wneu.2019.05.067
7. Maseda M., Uei H., Nakahashi M., Sawada H., Tokuhashi Y. Neurological outcome of treatment for patients with impending paralysis due to epidural spinal cord compression by metastatic spinal tumor. J Orthop Surg Res. 2019;14(1):291. DOI: 10.1186/s13018-019-1348-x
8. Laufer I., Rubin D.G., Lis E., Cox B.W., Stubblefield M.D., Yamada Y., et al. The NOMS framework: approach to the treatment of spinal metastatic tumors. Oncologist 2013;18(6):744–51. DOI: 10.1634/theoncologist.2012-0293
9. Balagamwala E.H., Naik M., Reddy C.A., Angelov L., Suh J.H., Djemil T., et al. Pain flare after stereotactic radiosurgery for spine metastases. J Radiosurg SBRT. 2018;5(2):99–105. PMID: 29657890
10. Guo L., Xu Q., Ke L., Wu Z., Zeng Z., Chen L., et al. The impact of radiosensitivity on clinical outcomes of spinal metastases treated with stereotactic body radiotherapy Cancer Medicine. 2023;12:13279–89. DOI: 10.1002/cam4.6019
11. Correia D., Moullet B., Cullmann J., Heiss R., Ermiş E., Aebersold D.M., et al. Response assessment after stereotactic body radiation therapy for spine and non-spine bone metastases: results from a single institutional study. Radiat Oncol. 2022;17(1):37. DOI: 10.1186/s13014-022-02004-7
12. Kelley K.D., Racareanu R., Sison C.P., Gogineni E., Rana Z., Gandhi S.V., et al. Outcomes in the radiosurgical management of metastatic spine disease. Adv Radiat Oncol. 2019;4(2):283–93. DOI: 10.1016/j.adro.2018.10.007
13. Kim Y.J., Kim J.H., Kim K., Kim H.J., Chie E.K., Shin K. H., et al. The feasibility of spinal stereotactic radiosurgery for spinal metatstases with epidural cord compression. Cancer Res Treat. 2019;51(4):1324–35. DOI: 10.4143/crt.2018.653
Об авторах
О. И. КитРоссия
Кит Олег Иванович — д.м.н., профессор, академик РАН, кафедра онкологии
Ростов-на-Дону
Д. Е. Закондырин
Россия
Закондырин Дмитрий Евгеньевич — к.м.н., отделение нейроонкологии
Ростов-на-Дону
А. А. Гринь
Россия
Гринь Андрей Анатольевич — д.м.н., доцент, член-корр. РАН, научное отделение неотложной нейрохирургии, кафедра фундаментальной нейрохирургии
Москва
Э. Е. Росторгуев
Россия
Росторгуев Эдуард Евгеньевич — д.м.н., отделение нейроонкологии
Ростов-на-Дону
Ю. В. Пржедецкий
Россия
Пржедецкий Юрий Валентинович — д.м.н., профессор, отделение реконструктивно-пластической хирургии и онкологии
Ростов-на-Дону
П. Г. Сакун
Россия
Сакун Павел Георгиевич — к.м.н., отделение радиотерапии № 2
Ростов-на-Дону
В. И. Вошедский
Россия
Вошедский Виталий Игоревич — к.м.н., отделение радиотерапии № 2
Ростов-на-Дону
Б. В. Матевосян
Россия
Матевосян Борис Варосович — отделение нейроонкологии
Ростов-на-Дону
Т. С. Шепеля
Россия
Шепеля Тимофей Сергеевич — студент 6-го курса
Ростов-на-Дону
Рецензия
Для цитирования:
Кит О.И., Закондырин Д.Е., Гринь А.А., Росторгуев Э.Е., Пржедецкий Ю.В., Сакун П.Г., Вошедский В.И., Матевосян Б.В., Шепеля Т.С. Метастатическое поражение позвоночника с минимальной эпидуральной компрессией: хирургическое лечение или стереотаксическая лучевая терапия? Креативная хирургия и онкология. 2024;14(2):127-135. https://doi.org/10.24060/2076-3093-2024-14-2-127-135
For citation:
Kit O.I., Zakondyrin D.E., Grin A.A., Rostorguev E.E., Przhedetskiy Y.V., Sakun P.G., Voshedskii V.I., Matevosian B.V., Shepelya T.S. Metastatic Spinal Lesion with Minimal Epidural Compression: Surgical Treatment or Stereotactic Radiotherapy? Creative surgery and oncology. 2024;14(2):127-135. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-127-135


































