Перейти к:
Ранние результаты объемно-модулированной лучевой терапии с симультанным интегрированным бустом (SIB-VMAT) в сочетании с темозоломидом в послеоперационном лечении глиобластомы Grade 4
https://doi.org/10.24060/2076-3093-2024-14-2-153-157
Аннотация
Введение. Глиобластома — злокачественная нейроэпителиальная опухоль головного мозга с агрессивным течением и неблагоприятным прогнозом. Медиана общей выживаемости составляет 14,6 месяца. Высокая частота рецидивов за счет большой скорости репопуляции опухолевых клонов, невозможность радикального удаления первичной опухоли объясняют сравнительно небольшую эффективность стандартных методов лечения. Одним из способов усиления локального контроля при глиомах является симультанный интегрированный буст. Материалы и методы. В ходе исследования проанализированы данные 25 пациентов, получивших химиолучевое лечение по поводу глиобластомы Grade 4 в Радиотерапевтическом отделении № 1 с сентября 2021 по март 2023 года (данные проанализированы в течение 1 года). В первой группе 15 пациентов получали лучевую терапию с симультанным интегрированным бустом (SIB-VMAT) в рамках химиолучевого лечения. Во второй группе 10 пациентов получали лучевую терапию в стандартном режиме фракционирования. Результаты и обсуждение. Переносимость лечения была удовлетворительной: целевая доза подведена у 100% больных без необходимости в вынужденных перерывах, показатели токсичности сопоставимы в обеих группах; 1-летний локорегионарный контроль составил в группе с применением симультанного интегрированного буста 46,7%, в группе стандартного режима фракционирования — 50%; 1-летняя общая выживаемость в группе с применением симультанного интегрированного буста составила 66,7%, в группе стандартного режима — 70%. В течение срока наблюдения случаев радионекроза зафиксировано не было. Результаты, полученные авторами в ходе настоящего исследования, сопоставимы с данными актуальных научных публикаций по теме исследования. Заключение. Лучевая терапия с использованием симультанного интегрированного буста в послеоперационном лечении глиобластомы Grade 4 — приемлемый и безопасный метод с умеренной токсичностью и удовлетворительными показателями общей выживаемости.
Ключевые слова
Для цитирования:
Никульшина Я.О., Редькин А.Н., Перова А.В. Ранние результаты объемно-модулированной лучевой терапии с симультанным интегрированным бустом (SIB-VMAT) в сочетании с темозоломидом в послеоперационном лечении глиобластомы Grade 4. Креативная хирургия и онкология. 2024;14(2):153-157. https://doi.org/10.24060/2076-3093-2024-14-2-153-157
For citation:
Nikulshina Y.O., Redkin A.N., Perova A.V. Early Results of Simultaneous Integrated Boost Volumetric Modulated arc Therapy (SIB-VMAT) Combined with Temozolomide in the Postoperative Treatment of Grade 4 glioblastoma. Creative surgery and oncology. 2024;14(2):153-157. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-153-157
ВВЕДЕНИЕ
Глиобластома — злокачественная нейроэпителиальная, преимущественно астроцитарная опухоль центральной нервной системы с агрессивным течением и неблагоприятным клиническим прогнозом [1]. Согласно классификации опухолей центральной нервной системы ВОЗ глиомы классифицируются по Grade [1][2]. Классификация основана на выявлении в микроскопической картине морфологического препарата одного из следующих признаков: ядерная атипия, митозы, пролиферация эндотелия сосудов, некрозы. Grade III характеризуется наличием многочисленных фигур митозов, а Grade IV — выраженной пролиферацией эндотелия сосудов и наличием некрозов. Глиобластомы относятся к опухолям Grade IV и вместе с глиомами Grade III составляют группу глиом высокой степени злокачественности [1][2]. Медиана общей выживаемости при глиобластоме составляет 14,6 месяца после стандартного лечения, включающего комбинацию оперативного лечения, лучевой терапии и химиотерапии [2]. Химиолучевое лечение при глиомах высокой степени злокачественности предполагает лучевую терапию в режиме стандартного фракционирования (2 Гр за фракцию) в суммарной очаговой дозе 60 Гр совместно с приемом темозоломида в дозе 75 мг/м²/сут на весь период лечения с последующим приемом темозоломида в адъювантном режиме (8–12 курсов) [1][2].
Высокая частота рецидивов за счет большой скорости репопуляции опухолевых клонов, невозможность радикального удаления первичной опухоли объясняют сравнительно небольшую эффективность стандартных методов терапии [3][4], что создает проблему в оказании качественной помощи и диктует необходимость разработки различных стратегий лечения глиобластом. Исследования показали, что примерно 90 % рецидивов происходит в пределах первоначальной области лечения [4–8], что может быть результатом недостаточного локального контроля [4–11]. Таким образом, стратегия повышения безрецидивного периода и общей выживаемости пациентов с глиобластомой может заключаться в усилении локального контроля путем увеличения поглощенной суммарной дозы облучения. Вместе с тем исследования показывают, что конформная лучевая терапия с высокой поглощенной дозой (85–90 Гр) не улучшает показателей общей выживаемости [10–12], в то же время способствуя увеличению частоты возникновения радионекроза нервной ткани. Гипофракционирование является альтернативным методом усиления биологического эффекта лучевой терапии: за счет более высокой дозы за фракцию компенсируется ускорение репопуляции опухолевых клеток [8][10–13]. Однако при увеличении разовой очаговой дозы при гипофракционировании также возрастает вероятность возникновения лучевого некроза [9][10][13][14]. Таким образом, становится крайне актуальным вопрос выбора целевых объемов облучения с различной очаговой дозой для соблюдения баланса дозного распределения внутри опухоли и достижения наилучшего терапевтического эффекта. Для данных целей была разработана методика симультанного интегрированного буста, позволяющая одновременно подводить различные терапевтические дозы для нескольких мишеней в едином плане лечения с оптимальным дозным распределением без увеличения общей продолжительности курса лечения [7–12].
Однако в литературе встречается сравнительно мало данных о применении методик интегрированного буста в лечении первичных опухолей ЦНС и, в частности, глиобластом [14].
МАТЕРИАЛЫ И МЕТОДЫ
В ходе исследования проанализированы данные 25 пациентов, получивших химиолучевое лечение по поводу глиобластомы Grade 4 в радиотерапевтическом отделении № 1 с сентября 2021 по март 2023 года (данные проанализированы в течение 1 года).
Целевые объемы облучения определялись на основании данных предоперационной и послеоперационной магнитно-резонансной томографии (МРТ) головного мозга, выполненной на высокопольном МР-томографе (1,5 Тл) с внутривенным контрастным усилением, и компьютерной томографии с толщиной среза 3 мм:
- СTV высокого риска = GTV contrast + 3–5 мм;
- CTV промежуточного риска = GTV edema + 6–8 мм;
- CTV низкого риска = GTV edema + 15–20 мм с учетом особенностей визуализации и расположения критических структур;
- PTV высокого, промежуточного и низкого риска = CTV высокого, промежуточного и низкого риска + 2–3 мм в соответствии с характеристиками аппарата, системы фиксации и навигации.
Лучевая терапия проводилась на линейных ускорителях Varian Halcyon с энергией 6 мэВ.
Пациенты были разделены на 2 группы:
Первая группа: 15 пациентов получали лучевую терапию с симультанным интегрированным бустом (SIB-VMAT, SIB-IMRT) и гипофракционирование в рамках химиолучевого лечения. На основании возможностей визуализации при использовании методики SIB выделены 3 и 2 целевых объема облучения:
- 3 объема: РД (2.1/2.0/1.8): СД (63/60/54) за 30 фракций на PTV высокого риска, PTV среднего риска и PTV низкого риска соответственно: 9 пациентов;
- 2 объема: РД (2.3/2.2): СД (57.5/55) 25 фр. на PTV высокого риска, PTV среднего риска и PTV низкого риска соответственно: 4 пациента;
- 2 объема: РД (2.2/2.0): СД (59.4/54) 27 фр. на PTV высокого риска, PTV среднего риска и PTV низкого риска соответственно: 2 пациента.
В данной группе частичный ответ зарегистрирован у 3 пациентов, стабилизация — у 4, прогрессирование — у 8 (из них умерли 5).
Вторая группа (контрольная): 10 пациентов получали лучевую терапию в стандартном режиме с последовательным сокращением объемов и без такового: РД (2): СД (60 Гр) за 30 фракций.
В данной группе: частичный ответ зафиксирован у 2 пациентов, стабилизация — у 3, прогрессирование — у 5 (из них умерли 3).
При выделении трех целевых объемов облучения проводилась лучевая терапия с применением симультанного интегрированного буста по методике SIB-VMAT один раз в день в разовой дозе РД (2.1/2.0/1.8): СД (63/60/54) Гр за 30 фракций на PTV высокого риска, PTV промежуточного риска и PTV низкого риска соответственно, за 30 фракций в течение 6 недель (рис. 1).
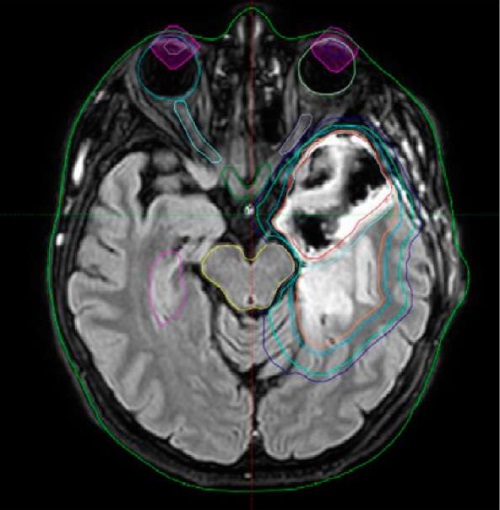
Рисунок 1. Пример оконтуривания с выделением трех целевых объемов облучения
Figure 1. An example of outlining three target volumes
При выделении двух целевых объемов лучевая терапия по методике SIB-VMAT проводилась один раз в день в разовой дозе РД (2.2/2.0): СД 59.4/54) Гр за 27 фракций, а также РД (2.3/2.2): СД (57.5/55) Гр за 25 фракций на целевые объемы PTV высокого риска и PTV промежуточного риска соответственно.
Пациенты контрольной группы получали лучевую терапию в стандартном режиме фракционирования с последовательным сокращением объемов и без такового в режиме РД (2 Гр): СД (60 Гр) за 30 фракций.
Целью дозиметрического планирования было достижение покрытия изодозой, охватывающей по меньшей мере 95 % от PTV так, чтобы не более 10 % PTV получали более 110 % от предписанной дозы. Для ограничения поглощенной дозы на критические структуры использовались критерии QUANTEC и RTOG (рис. 2).
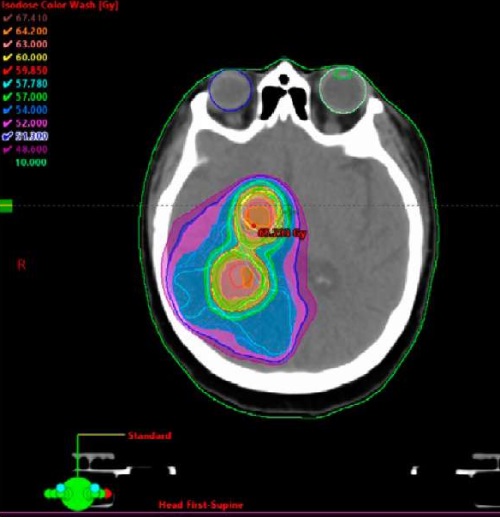
Рисунок 2. Пример распределения поглощенной дозы внутри целевых объемов для рассчитанного плана облучения по методике SIB-VMAT
Figure 2. Example of absorbed dose distribution within target volumes for a calculated SIB-VMAT exposure
Лучевая терапия проводилась в сочетании с химиотерапией темозоломидом в дозе 75 мг/м²/сут, 7 дней в неделю, с первого дня до окончания лучевой терапии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из 15 пациентов, получивших лучевую терапию с симультанным интегрированным бустом, прогрессирование зафиксировано у 53,3 % больных и было сопоставимо с группой стандартного режима фракционирования — 50 %.
Переносимость лечения была удовлетворительной: целевая доза подведена у 100 % больных без необходимости в вынужденных перерывах, показатели токсичности сопоставимы в обеих группах:
- 1-летний локорегионарный контроль составил в группе с применением симультанного интегрированного буста 46,7 %, в группе стандартного режима фракционирования — 50 %;
- 1-летняя общая выживаемость в группе с применением симультанного интегрированного буста составила 66,7 %, в группе стандартного режима 70 %.
В течение срока наблюдения случаев радионекроза зафиксировано не было.
Основными факторами неблагоприятного прогноза были: мультицентрический тип опухоли, наличие кистозного компонента, выраженный перитуморальный отек, локализация опухоли в перивентрикулярной зоне с компрессией желудочковой системы, распространение опухоли на ствол мозга, явления неврологического дефицита.
По данным актуальных научных публикаций, лучевая терапия с использованием симультанного интегрированного буста в лечении глиобластомы Grade 4 является методом с удовлетворительными показателями локорегионарного контроля и общей выживаемости. Так, S. Scoccianti и соавт. установили, что 1-летняя общая выживаемость у пациентов с глиобластомой, получавших лучевую терапию по методике SIB-VMAT, составила 65,6 % [14]. По данным L. Zhong и соавт., 1-летняя общая выживаемость в группе с применением симультанного интегрированного буста составила 68,6 % [5]. Согласно исследованию F. Gregucci и соавт., 1-летний локорегионарный контроль в группе пациентов с глиобластомой, пролеченных по методике SIB-VMAT, составил 52,6 % [7]. Авторы также отмечают удовлетворительную переносимость лечения с умеренными показателями токсичности [5–9][13][14]. Таким образом, результаты, полученные авторами в ходе настоящего исследования, сопоставимы c данными актуальных научных публикаций.
ЗАКЛЮЧЕНИЕ
Лучевая терапия с использованием симультанного интегрированного буста в послеоперационном лечении глиобластомы Grade 4 — приемлемый и безопасный метод с умеренной токсичностью и удовлетворительными показателями общей выживаемости.
Для достижения задачи улучшения показателей локорегионарного контроля у пациентов с глиобластомой Grade 4 при лучевой терапии в рамках химиолучевого лечения потребуется исследование с привлечением большего числа пациентов с более длительным периодом наблюдения и детальным анализом факторов неблагоприятного клинического прогноза. В настоящее время на базе радиотерапевтического отделения № 1 (дневной стационар БУЗ ВО «ВОКОД») ведется работа в данном направлении.
Список литературы
1. Яковленко Ю.Г. Глиобластомы: современное состояние проблемы. Медицинский вестник Юга России. 2019;10(4):28–35. DOI: 10.21886/2219-8075-2019-10-4-28-35
2. Ostrom Q.T., Gittleman H., Truitt G., Boscia A., Kruchko C., Barnholtz-Sloan J.S. CBTRUS Statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2011–2015. NeuroOncol. 2018;20(1):81–6. DOI: 10.1093/neuonc/noy131
3. Wang J.Z., Li X.A. Impact of tumor repopulation on radiotherapy planning. Int J Radiat Oncol Biol Phys. 2005;61(1):220–7. DOI: 10.1016/j.ijrobp.2004.09.043
4. Piroth M.D., Pinkawa M., Holy R., Stoffels G., Demirel C., Attieh C., et al. Integrated-boost IMRT or 3-D-CRT using FET-PET based autocontoured target volume delineation for glioblastoma multiforme — a dosimetric comparison. Radiation Oncology. 2019;4(2):57–9. DOI: 10.1186/1748-717X-4-57
5. Zhong L., Chen L., Shengqing L. Efficacy of moderately hypofractionated simultaneous integrated boost intensitymodulated radiotherapy combined with temozolomide for the postoperative treatment of glioblastoma multiforme: a single-institution experience. Radiation Oncology. 2019;14(1):104–8. DOI: 10.1186/s13014-019-1305-1
6. Cao J.Q., Fisher B.J., Bauman G.S., Megyesi J.F., Watling C.J., Macdonald D.R. Hypofractionated radiotherapy with or without concurrent temozolomide in elderly patients with glioblastoma multiforme: a review of ten-year single institutional experience. J Neurooncol. 2012;107(2):395–405. DOI: 10.1007/s11060-011-0766-3
7. Gregucci F., Bonaparte I., Laera L., Ciliberti M.P., Carbonara R., Gentile M.A., et al. Poor-prognosis patients affected by glioblastoma: retrospective study of hypofractionated radiotherapy with simultaneous integrated boost and concurrent/adjuvant temozolomide. J Pers Med. 2021;11(2):1145–52. DOI: 10.3390/jpm11111145
8. El-Ghany Khedr R.A., Sheta M.F., Elmorsy W. The outcomes of concomitant hypofractionated simultaneous integrated boost intensitymodulated radiotherapy with temozolomide for newly diagnosed high-grade gliomas. Oncol Radiother. 2015;12(1):20–9.
9. Shenouda G., Souhami L., Petrecca K., Owen S., Panet-Raymond V., Guiot M.C., et al. A phase 2 trial of neoadjuvant temozolomide followed by hypofractionated accelerated radiation therapy with concurrent and adjuvant temozolomide for patients with glioblastoma. Int J Radiat Oncol Biol Phys. 2017;97(3):487–94. DOI: 10.1016/j.ijrobp.2016.11.006
10. Nie E., Miao F., Jin X., Wu W., Zhou X., Zeng A., et al. Fstl1/DIP2A/ MGMT signaling pathway plays important roles in temozolomide resistance in glioblastoma. Oncogene. 2019;38(15):2706–21. DOI: 10.1038/s41388-018-0596-2
11. Dobelbower M.C., Burnet Iii O.L., Nordal R.A., Nabors L.B., Markert J.M., Hyatt M.D., et al. Patterns of failure for glioblastoma multiforme following concurrent radiation and temozolomide. J Med Imaging Radiat Oncol. 2011;55(1):77–81. DOI: 10.1111/j.1754-9485.2010.02232.x
12. Minniti G., Amelio D., Amichetti M., Salvati M., Muni R., Bozzao A., et al. Patterns of failure and comparison of different target volume delineations in patients with glioblastoma treated with conformal radiotherapy plus concomitant and adjuvant temozolomide. Radiother Oncol. 2010;97(3):377–81. DOI: 10.1016/j.radonc.2010.08.020
13. Mallick S., Kunhiparambath H., Gupta S., Benson R., Sharma S., Laviraj M.A., et al. Hypofractionated accelerated radiotherapy (HART) with concurrent and adjuvant temozolomide in newly diagnosed glioblastoma: a phase II randomized trial (HART-GBM trial). J Neuro-Oncol. 2018;140(1):75–82. DOI: 10.1007/s11060-018-2932-3
14. Scoccianti S., Krengli M., Marrazzo L., Magrini S.M., Detti B., Fusco V., et al. Hypofractionated radiotherapy with simultaneous integrated boost (SIB) plus temozolomide in good prognosis patients with glioblastoma: a multicenter phase II study by the brain study Group of the Italian Association of radiation oncology (AIRO). Radiol Med. 2018;123(1):48–62. DOI: 10.1007/s11547-017-0806-y
Об авторах
Я. О. НикульшинаРоссия
Никульшина Яна Олеговна — аспирант, кафедра онкологии, радиотерапевтическое отделение № 1
Воронеж
А. Н. Редькин
Россия
Редькин Александр Николаевич — д.м.н., профессор, кафедра онкологии
Воронеж
А. В. Перова
Россия
Перова Анастасия Владимировна — радиотерапевтическое отделение № 1
Воронеж
Рецензия
Для цитирования:
Никульшина Я.О., Редькин А.Н., Перова А.В. Ранние результаты объемно-модулированной лучевой терапии с симультанным интегрированным бустом (SIB-VMAT) в сочетании с темозоломидом в послеоперационном лечении глиобластомы Grade 4. Креативная хирургия и онкология. 2024;14(2):153-157. https://doi.org/10.24060/2076-3093-2024-14-2-153-157
For citation:
Nikulshina Y.O., Redkin A.N., Perova A.V. Early Results of Simultaneous Integrated Boost Volumetric Modulated arc Therapy (SIB-VMAT) Combined with Temozolomide in the Postoperative Treatment of Grade 4 glioblastoma. Creative surgery and oncology. 2024;14(2):153-157. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-153-157


































