Перейти к:
Флуоресцентная диагностика и фотодинамическая терапия в циторедуктивном хирургическом лечении больной перитонеальным канцероматозом
https://doi.org/10.24060/2076-3093-2024-14-2-186-193
Аннотация
Введение. Перитонеальный канцероматоз, являющийся одной из наиболее агрессивных форм метастазирования, представляет собой серьезную клиническую проблему. Традиционные методы лечения, такие как циторедуктивная хирургия и системная химиотерапия, ограничены в своей эффективности. Новые подходы, включающие фотодинамическую терапию и флуоресцентную диагностику, открывают перспективные направления для улучшения результатов комплексного лечения данной категории больных. Материалы и методы. В статье представлен клинический случай лечения пациентки с перитонеальными метастазами рака яичника, осложненного нарушением тонкокишечной проходимости и некрозом опухоли, демонстрирующий результаты комплексного применения фотодинамических технологий и этапного циторедуктивного хирургического лечения. На первом этапе циторедуктивного оперативного вмешательства, приоритетной целью которого являлось устранение жизнеугрожающих осложнений, выполнялись флуоресцентная диагностика и фотодинамическая терапия для контроля полноты циторедукции, оценки характера подозрительных опухолевых очагов и воздействия на резидуальную опухоль. В рамках второго этапа хирургического лечения осуществлялись завершение циторедукции под контролем флуоресцентной диагностики и внутрибрюшная химиогипертермическая перфузия. Также проведена оценка результатов применения флуоресцентной диагностики для определения опухолевого поражения брюшины в целях объективизации выбора объема перитонэктомии. Результаты и обсуждение. Применение описанного подхода за счет интраоперационной диагностики и направленного противоопухолевого воздействия на остаточные опухолевые очаги привело к повышению эффективности циторедуктивного вмешательства. Оценка качества жизни по анкете SF-36 в послеоперационном периоде продемонстрировала значимое улучшение как физического, так и психологического компонентов здоровья в течение трех месяцев наблюдения. Заключение. Интеграция фототераностики в программу циторедуктивного оперативного лечения больных перитонеальным канцероматозом представляет собой инновационный подход, который обладает потенциальной возможностью повышения не только точности интраоперационной диагностики распространенности опухолевого процесса по брюшине, но и эффективности циторедуктивных вмешательств. Однако для полной оценки лечебного потенциала и подтверждения эффективности предложенного варианта лечения требуются дальнейшие клинические исследования.
Ключевые слова
Для цитирования:
Рудаков Д.А., Суров Д.А., Соловьев И.А., Балюра О.В., Бромберг Б.Б., Сизоненко Н.А., Есаян И.Л., Нгуен В. Флуоресцентная диагностика и фотодинамическая терапия в циторедуктивном хирургическом лечении больной перитонеальным канцероматозом. Креативная хирургия и онкология. 2024;14(2):186-193. https://doi.org/10.24060/2076-3093-2024-14-2-186-193
For citation:
Rudakov D.A., Surov D.A., Soloviev I.A., Balura O.V., Bromberg B.B., Sizonenko N.A., Esayan I.L., Nguyen V. Fluorescence Diagnostics and Photodynamic Therapy in Cytoreductive Surgical Treatment of Peritoneal Carcinomatosis Patient. Creative surgery and oncology. 2024;14(2):186-193. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-186-193
ВВЕДЕНИЕ
Перитонеальный канцероматоз (ПК) представляет собой диссеминацию опухолевых клеток по брюшине с формированием метастатических очагов и является одной из наиболее неблагоприятных форм прогрессирования злокачественных новообразований различных локализаций [1]. Наиболее частыми источниками ПК являются опухоли яичников и желудочно-кишечного тракта, реже возможно развитие ПК как первичного заболевания в случаях мезотелиомы и псевдомиксомы брюшины [2].
Подходы к комплексному лечению больных ПК и его прогноз существенно различаются в зависимости от типа первичной опухоли, при этом развитие жизнеугрожающих осложнений неизбежно вносит коррективы в тактические подходы. Вместе с тем у значительного числа пациентов, несмотря на применение различных методов лечения, прогноз все же остается неблагоприятным, а терапия носит паллиативный характер [3]. Существующие методы лечения, такие как циторедуктивная хирургия, внутрибрюшная химиогипертермическая перфузия (ВХГП) и системная химиотерапия, демонстрируют ограниченную эффективность, а выживаемость у большинства пациентов остается недостаточно высокой [4]. В этой связи значительная частота рецидивов после полного циторедуктивного оперативного лечения также требует разработки дополнительных стратегий лечения и методов интраоперационной диагностики полноты циторедукции, направленных в первую очередь на оставшиеся не визуализированными в брюшной полости опухолевые очаги [5].
Перспективным направлением, способным не только оказать противоопухолевое воздействие, но и определить степень распространения патологического процесса по брюшине и тем самым установить окончательный объем оперативного вмешательства, является использование флуоресцентной диагностики (ФД) и фотодинамической терапии (ФДТ), объединенных единым тераностическим принципом.
Несмотря на многие обнадеживающие клинические результаты применения фототераностики, она по-прежнему остается клинически недостаточно используемым методом в хирургии и онкологии. Это подчеркивает необходимость дальнейших исследований для оценки ее эффективности в сочетании с хирургическим лечением и химиотерапией [6].
В этой связи очевидный интерес представляет изучение возможностей применения и оценка эффективности ФД и ФДТ в рамках двухэтапного циторедуктивного оперативного лечения, включающего ВХГП, у пациентов с осложнениями ПК, что демонстрирует приведенный ниже клинический случай.
МАТЕРИАЛЫ И МЕТОДЫ
Больная Р., 58 лет, поступила в многопрофильный стационар 13.11.2023 с диагнозом направления — напряженный асцит. После устранения развившегося осложнения и коррекции постэвакуаторных нарушений пациентка была комплексно обследована, в результате чего был сформулирован диагноз: «Рак яичников pT3cNxM0G1 IIIc ст. Напряженный асцит от 11.2023 г. Диагностическая лапароскопия, биопсия большого сальника от 14.11.2023. Гистологическое исследование с ИГХ от 21.11.2023: серозная карцинома яичников high grade».
По данным СКТ с внутривенным контрастированием в полости малого таза справа отмечалось образование с четкими ровными контурами, неравномерно накапливающее контрастное вещество, размерами 71×55 мм, интимно прилежащее к петлям тонкой кишки и исходящее из правого яичника. Кроме того, визуализировалось тяжистое уплотнение желудочно-ободочной связки, преимущественно слева, с наличием на этом фоне бляшковидных мягкотканных образований, накапливающих контрастное вещество, размерами до 10×33 мм; канцероматоз в области левого купола диафрагмы, инфильтрация сальника по типу «omental cake» с признаками некроза опухоли и абсцедирования. Вокруг печени и селезенки, по фланкам живота, межпетельно и в нижнем отделе полости брюшины определялась жидкость. Также обращало на себя внимание наличие признаков нарушения тонкокишечной проходимости (рис. 1).
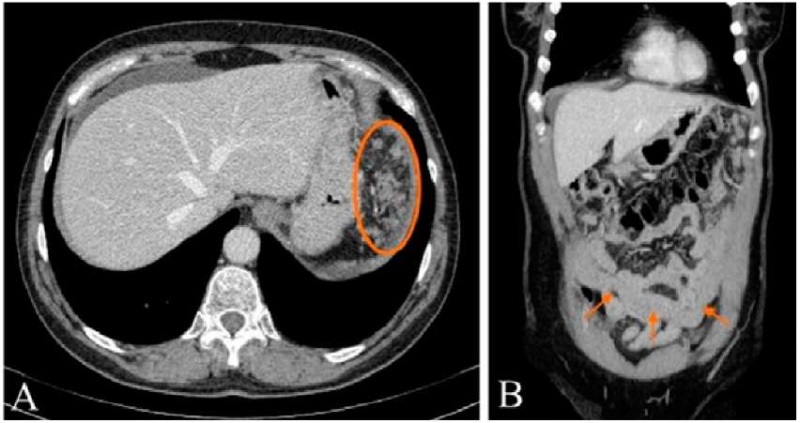
Рисунок 1. Спиральная компьютерная томография органов живота и таза больной Р., 58 лет: А — канцероматоз брюшины в левом верхнем квадранте брюшной полости; В — опухолевая инфильтрация сальника по типу «omental cake»
Figure 1. Female patient R., 58 years old. Spiral computed tomography of abdominal and pelvic organs. A — carcinomatosis of peritoneum in the left upper quadrant of abdominal cavity; B — tumor infiltration by omental cake type
МРТ малого таза в правой подвздошной области выявила преимущественно солидной структуры объемное образование с неровными бугристыми контурами, дольчатого строения, с признаками рестрикции диффузии и неоднородным набором контрастного вещества (участки некроза), общими размерами до 73×52×82 мм; исходящее из правого яичника и тесно прилежащее к правым отделам матки на протяжении до 36 мм (клетчатка между данными структурами не прослеживается). В дугласовом пространстве по тазовой брюшине определялись мягкотканные депозиты размерами от 5 мм до максимально в области перитонеальной складки брюшины 37×8×10 мм. По нижней стенке сигмовидного отдела кишки (примерно в 11 см от зубчатой линии) определялся аналогичный по сигнальным характеристикам участок перитонеального канцероматоза толщиной до 7,5 мм, примерной протяженностью до 42 мм, с признаками выраженного сужения просвета кишки на данном уровне. На границе уровня сканирования было выявлено ограничение диффузии и изоинтенсивный сигнал от сальника, с его утолщением до 12 мм, примерной протяженностью до 85 мм. Визуализировалось умеренное количество свободной жидкости в позадиматочном пространстве и по правому фланку (рис. 2).
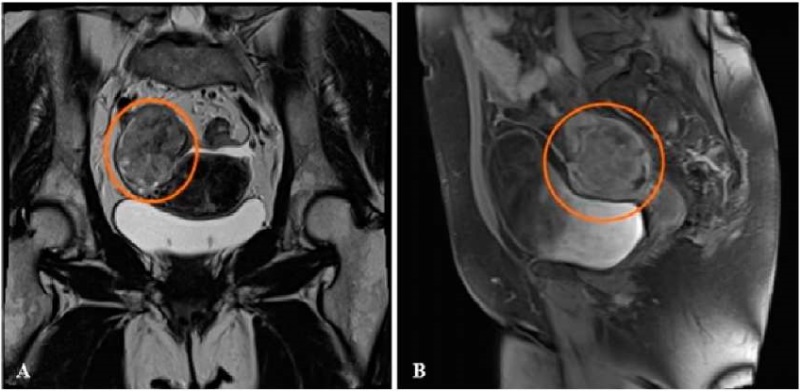
Рисунок 2. Магнитно-резонансная томография органов таза больной Р., 58 лет. Опухоль в малом тазу с признаками некроза
Figure 2. Female patient R., 58 years old: magnetic resonance imaging of pelvic organs. Pelvic tumor with signs of necrosis
Исходя из результатов предоперационной лучевой диагностики был рассчитан индекс перитонеального канцероматоза (PCI — СТ), который составил 18 баллов. При этом индекс PCI по данным лапароскопической диагностики был равен 23 баллам.
Проведенный анализ преморбидного фона пациентки выявил наличие атеросклероза аорты и коронарных артерий, гипертоническую болезнь I стадии, хронический гастрит вне обострения, аденому левого надпочечника, нетоксический узловой зоб, эутиреоз на фоне приема тироксикана 25 мкг/сут.
23.11.2023 у пациентки появились жалобы на интенсивную боль в животе, рвоту, выраженную слабость. Принимая во внимание результаты обследования, появление клинической картины декомпенсации нарушений проходимости тонкой кишки и перитонеальной симптоматики, было принято решение о выполнении оперативного вмешательства.
С целью интраоперационной оценки распространенности опухолевого процесса и проведения ФДТ в ходе предоперационной подготовки за 3 часа до операции в течение 30 минут осуществлялась инфузия препарата фоторан Е6 в дозировке 2,5 мг/кг (170 мг при массе тела пациентки 68 кг).
23.11.2023 в ходе операции при проведении последовательной этапной ревизии было установлено, что большой сальник полностью замещен опухолью c очагами некрозов, плотно фиксирован к терминальному отделу подвздошной кишки и к слепой кишке (рис. 3). Петли тонкой кишки раздуты, вяло перистальтируют, переполнены жидким содержимым — субкомпенсированное нарушение кишечной проходимости. Полость малого таза выполнена опухолевым конгломератом, органная дифференцировка не представлялась возможной, определялась опухолевая инвазия в заднюю стенку мочевого пузыря, прямую кишку. На поверхности опухолевого конгломерата, выполняющего полость малого таза, были выявлены многочисленные участки некроза. На париетальной брюшине обеих латеральных каналов и верхних квадрантов брюшной полости определялись многочисленные метастазы — канцероматоз. Данные предоперационной лучевой диагностики были скорректированы, и интраоперационный индекс PCI оказался равен 23 баллам.
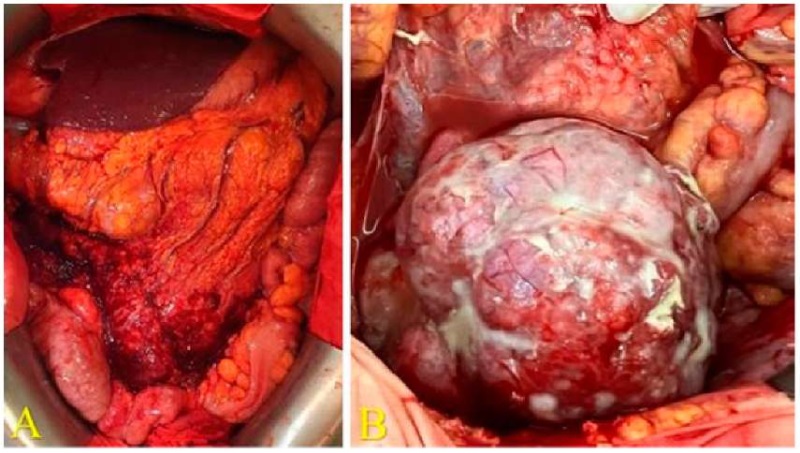
Рисунок 3. Интраоперационная фотография. Больная Р., 58 лет. А — обзорная фотография брюшной полости после выполнения лапаротомии; В — опухоль яичника, осложненная некрозом
Figure 3. Intraoperative image. Female patient R., 58 years old. A — overview of the abdominal cavity after laparotomy; B — ovarian necrotic tumor
Учитывая данные интраоперационной ревизии, наличие жизнеугрожающих осложнений в виде некроза опухоли и субкомпенсированных нарушений кишечной проходимости, было принято решение о выполнении циторедуктивного оперативного вмешательства.
Под сочетанной анестезией была выполнена задняя супралеваторная эвисцерация малого таза, резекция задней стенки мочевого пузыря, правосторонняя гемиколэктомия, оментэктомия, резекция связочного аппарата печени, спленэктомия, тазовая, диафрагмальная перитонэктомия и перитонэктомия обоих латеральных квадрантов брюшной полости. Реконструктивный этап операции включал формирование аппаратного илеотрансверзоанастомоза и колостомы в левой латеральной области. Был сформирован илеотрансверзоанастомоз, в левой латеральной области — концевая колостома.
После завершения реконструктивного этапа осуществлен лаваж брюшной полости и контроль полноты циторедукции методом ФД (лазер АЛОД-01 с длиной волны 405 нм), который позволил выявить резидуальные опухолевые очаги на поверхности правого купола диафрагмы, не определявшиеся визуально (рис. 4). Учитывая данные ФД, объем диафрагмальной перитонэктомии был увеличен (рис. 5).
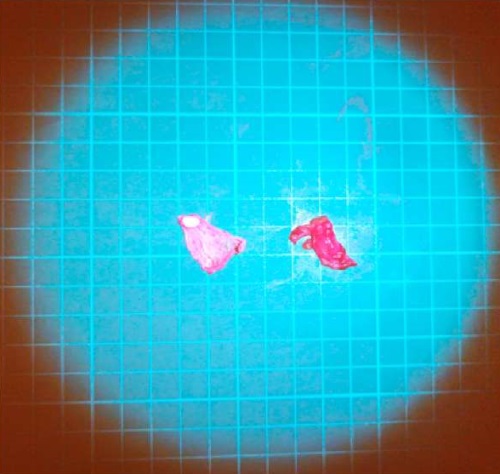
Рисунок 4. Участки визуально неизмененной париетальной брюшины в условиях света с длиной волны 405 нм с желтым светофильтром: слева — интактная париетальная брюшина, справа — с флуоресценцией
Figure 4. Sections of visually unchanged parietal peritoneum under 405 nm light with a yellow filter: left — intact parietal peritoneum, right — with fluorescence
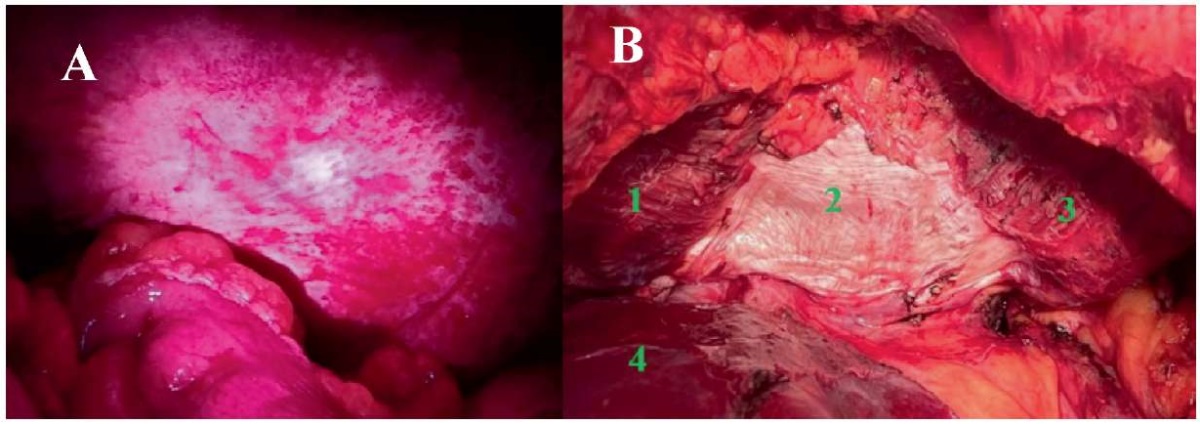
Рисунок 5. А — ФД в области верхних квадрантов брюшной полости (фотография в условиях света с длиной волны 405 нм с желтым светофильтром; малиновое свечение невизуализированной опухолевой ткани); В — вид диафрагмы после завершения диафрагмальной перитонэктомии (1 — правый купол диафрагмы; 2 — сухожильный центр; 3 — левый купол диафрагмы; 4 — левая доля печени)
Figure 5. A — FD in upper quadrants of the abdominal cavity (under 405 nm light with a yellow filter; crimson glow of unvisualized tumor tissue); B — view of the diaphragm after diaphragmatic peritonectomy (1 — right dome of the diaphragm; 2 — tendinous center; 3 — left dome of the diaphragm; 4 — left lobe of the liver)
Принимая во внимание значительный объем оперативного вмешательства, объем кровопотери и обусловленную ими тяжесть состояния пациентки от продолжения оперативного вмешательство было принято решение воздержаться и применить тактику этапного хирургического лечения. Выполнен сеанс ФДТ в режиме: длина волны 662 нм с низкоинтенсивным излучением (плотность мощности Ps = 20 мВт/см², плотность энергии Pw = 10 Дж/см²) [7].
Таким образом, в результате выполненного оперативного вмешательства удалось достичь индекса полноты циторедукции СС0. В целях дополнительного противоопухолевого воздействия на втором этапе хирургического лечения было запланировано выполнение ВХГП по мере стабилизации состояния больной и устойчивой компенсации нарушений гомеостаза (7–10-е сутки послеоперационного периода).
Иммуногистохимическое исследование удаленной опухоли выявило high grade серозную карциному яичников с вовлечением белочной оболочки, лимфоваскулярной инвазией, некрозами, метастазы в большой сальник, распространенный канцероматоз брюшины. При этом исследование методом световой микроскопии канцероматозных узлов, повергшихся фотодинамическому воздействию, показало отсутствие очагов аденокарциномы в препаратах (рис. 6).
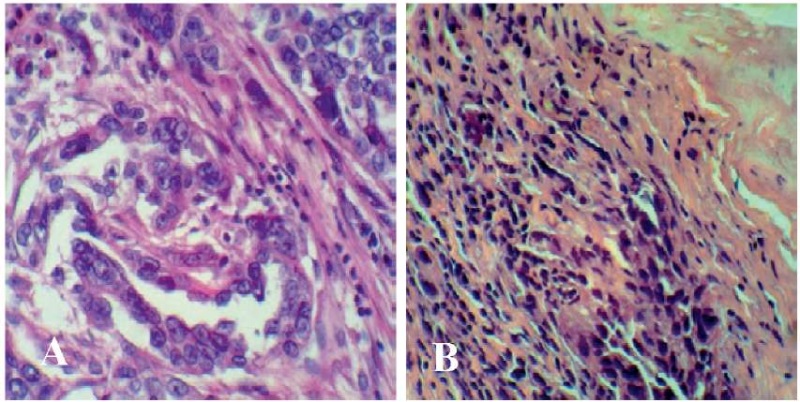
Рисунок 6. Световая микроскопия гистологического материала. Окраска гематоксилином и эозином; ув. 400. А — париетальная брюшина, пораженная канцероматозом, до проведения ФДТ; В — париетальная брюшина, пораженная канцероматозом, после проведения ФДТ
Figure 6. Light microscopy of histological material. Staining with hematoxylin and eosin, x 400 eq. A — parietal peritoneum affected by carcinomatosis before PDT; B — parietal peritoneum affected by carcinomatosis after PDT treatment
Кроме того, в результате гистологического исследования было установлено, что, несмотря на отсутствие видимых метастатических изменений в правом верхнем квадранте живота, на париетальной брюшине правого купола диафрагмы имеет место разрастание аденокарциномы. Данное обстоятельство позволило сделать вывод об оправданности применения ФД в целях контроля полноты циторедукции.
На 11-е сутки послеоперационного периода в результате многокомпонентной консервативной терапии удалось устранить нарушения гомеостаза, достичь нормализации клинико-лабораторных показателей, в связи с чем было принято решение о выполнении второго этапа циторедуктивного хирургического лечения.
04.12.2023 в ходе релапаротомии осуществлены последовательная ревизия брюшной полости и ФД с целью контроля полноты циторедукции, выполненной на первом этапе хирургического лечения — резидуальных опухолевых очагов не обнаружено. После выполнения аортокавальной, аортоподвздошной, бифуркационной лимфодиссекции проведена ВГХП в режиме: митомицин С 20 мг/м², температура перфузата — 44 °C, продолжительность перфузии — 60 минут (рис. 7).
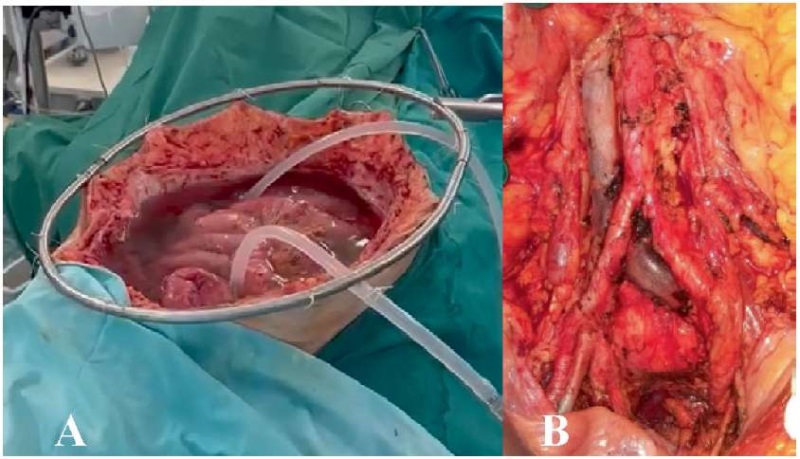
Рисунок 7. Интраоперационная фотография. Больная Р., 58 лет. А — вид операционного поля после завершения аортокавальной, аортоподвздошной, бифуркационной лимфодиссекции; В — этап внутрибрюшной гипертермической химиоперфузии
Figure 7. Intraoperative image. Female patient R., 58 years old. A — view of the surgical site after aortocaval, aortoiliac, bifurcation lymph dissection; B — stage of intraabdominal hyperthermic chemoperfusion
В послеоперационном периоде у пациентки развился правосторонний гидроторакс, потребовавший пункции плевральной полости. На 13-е сутки после второго этапа операции больная была выписана на амбулаторное лечение в удовлетворительном состоянии.
В течение трех месяцев после выписки из стационара осуществляли мониторинг состояния пациентки (опросник SF-36). Изучали качество жизни при поступлении, при выписке и спустя 1 и 3 месяца (рис. 8).
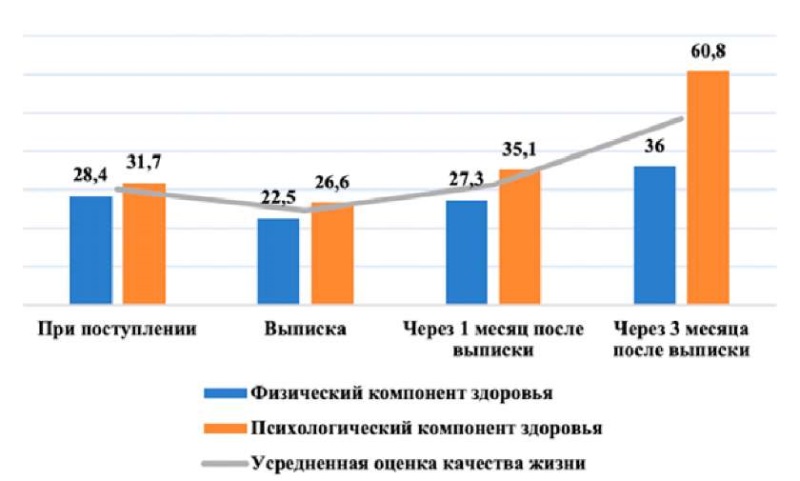
Рисунок 8. Динамика показателей качества жизни пациентки Р., 58 лет по шкале SF-36
Figure 8. Patient R., 58 years old. Dynamics of quality-of-life indicators on the SF-36 scale
Обращало на себя внимание восстановление физического и психологического компонентов здоровья до предоперационного уже к 1-му месяцу после выписки, а к 3-му месяцу психологический компонент превосходил дооперационный почти в два раза.
К моменту написания статьи безрецидивная выживаемость пациентки составляет 4 месяца.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ПК, как правило, характеризуется бурным и агрессивным течением, часто приводящим к серьезным жизнеугрожающим осложнениям. Традиционные подходы к хирургическому лечению, ориентированные на удаление видимых опухолевых узлов или устранение осложнений, вызванных опухолью, не всегда гарантируют приемлемые отдаленные результаты и улучшение качества жизни пациентов.
В настоящее время циторедуктивные оперативные вмешательства играют ключевую роль в комплексном лечении больных ПК различной этиологии [8]. Основной целью циторедуктивной операции является максимально возможное удаление опухолевой ткани, что достигается за счет выполнения мультивисцеральных резекций и перитонэктомии [9–11].
Применение в клинической практике комбинаций циторедуктивной хирургии и ВХГП существенно изменило представления о тактике лечения данных пациентов и создало предпосылки для увеличения их выживаемости [11].
В то же время, как демонстрируют многочисленные исследования, достижение абсолютной санации брюшной полости от опухолевых клеток невозможно, что, в свою очередь, обусловливает необходимость применения дополнительных технологий, направленных на подавление резидуальных очагов [12].
Патофизиологические характеристики канцероматоза брюшины, а именно то, что перитонеальные метастазы имеют незначительную инвазию в подлежащие структуры, теоретически делают его наиболее подходящей формой для лечения с применением ФДТ, где селективное поглощение фотосенсибилизатора опухолевыми клетками и целенаправленное световое облучение могут избирательно разрушать опухоль [13]. Это обеспечивает эффективное противоопухолевое воздействие с минимальным влиянием на соседние анатомические образования (органы желудочно-кишечного тракта, кровеносные сосуды и т. д.), что, в свою очередь, снижает побочные эффекты проводимой терапии [3]. В то же время для хирурга применение флюоресценции может стать ценным клиническим инструментом для улучшения визуализации опухолевого роста, определения границ хирургической резекции и обеспечения достаточного уровня безопасности оперативного вмешательства [13].
В частности, в работе Y. Liu et al. (2014) продемонстрированы успешные результаты сочетания циторедуктивной хирургии, ВХГП и ФД, которое, по мнению авторов, является эффективным и относительно безопасным вариантом лечения у отдельных больных с ПК [14]. Однако в данном исследовании не был использован весь потенциал фототераностического метода в диагностике и лечении ПК. Вероятно, что применение в рамках одного оперативного вмешательства таких этапов, как циторедукция, ВХГП, ФД и ФДТ, может существенно увеличить длительность вмешательства и периоперационные риски для пациента. В то же время появление работ [15][16], обосновывающих целесообразность выполнения двухэтапных циторедуктивных вмешательств у больных, страдающих диссеминированными опухолями брюшной полости и малого таза, в качестве безопасного и эффективного тактического подхода, делает возможным объединение вышеперечисленных методов в рамках комплексного лечения конкретного пациента.
В этой связи применение инновационных циторедуктивных технологий, включающих ФД и ФДТ, может представлять собой один из возможных путей повышения эффективности комплексного лечения больных ПК при раке яичника. Их применение не только способствует объективизации определения объема резекции и перитонэктомии, но и создает предпосылки для повышения эффективности противоопухолевого воздействия на резидуальные очаги, в том числе микроскопические, что наглядно подтверждается данным клиническим наблюдением.
Несмотря на потенциальную эффективность изложенного выше подхода, необходимо подчеркнуть, что сочетанное применение циторедуктивных технологий может существенно увеличивать периоперационные риски, которые сопряжены с увеличением частоты периоперационных осложнений и летальности. Тактика этапного хирургического лечения, вероятно, является одним из возможных вариантов решения данной проблемы, однако не обеспечивает достаточно высокого уровня безопасности пациента. В этой связи представляется целесообразным дальнейшее изучение возможностей комплексного лечения больных ПК, в том числе его осложненных форм. В частности, необходимо уточнение последовательности применения отдельных элементов фототераностики в рамках циторедуктивного оперативного вмешательства, обоснование режимов их выполнения, а также изучение взаимного противоопухолевого влияния ФДТ и ВГХП.
Успешное решение данных задач, на наш взгляд, может способствовать улучшению результатов лечения больных ПК.
ЗАКЛЮЧЕНИЕ
В данном клиническом наблюдении продемонстрирована возможность выполнения, безопасность и эффективность применения этапного циторедуктивного лечения больных ПК при раке яичников. Показано, что интраоперационное применение ФД повышает точность визуализации опухолевых очагов на поверхности брюшины и обосновывает выбор объема циторедукции и перитонэктомии. Кроме того, выполнение ФДТ, являющейся относительно малотравматичной технологией, обеспечивает условия для дополнительного противоопухолевого воздействия в рамках циторедуктивной хирургии. Фототераностический подход, как показал данный клинический случай, может быть безопасно реализован в сочетании с ВГХП, являющейся в настоящее время одним из немногих эффективных методов лечения больных ПК.
Таким образом, интеграция ФД и ФДТ в хирургическое лечение пациентов с перитонеальными метастазами представляет собой инновационный подход, который открывает новые возможности и требует дальнейшего изучения.
Список литературы
1. Ганцев Ш.Х., Ганцев К.Ш., Кзыргалин Ш.Р., Ишмуратова К.Р. Перитонеальный канцероматоз при злокачественных новообразованиях различных локализаций. Достижения и перспективы. Креативная хирургия и онкология. 2021;11(2):149– 56. DOI: 10.24060/2076-3093-2021-11-2-149-156
2. Ren K., Xie X., Min T., Sun T., Wang H., Zhang Y., et al. Development of the peritoneal metastasis: a review of back-grounds, mechanisms, treatments and prospects. J Clin Med. 2022;12(1):103. DOI: 10.3390/jcm12010103
3. Almerie M.Q., Gossedge G., Wright K.E., Jayne D.G. Treatment of peritoneal carcinomatosis with photodynamic therapy: Systematic review of current evidence. Photodiagnosis Photodyn Ther. 2017;20:276–86. DOI: 10.1016/j.pdpdt.2017.10.021
4. Ганцев Ш.Х., Забелин М.В., Ганцев К.Ш., Измайлов А.А., Кзыргалин Ш.Р. Перитонеальный канцероматоз: мировые научные школы и современное состояние вопроса. Креативная хирургия и онкология. 2021;11(1):85–91. DOI: 10.24060/2076-3093-2021-11-1-85-91
5. Azaïs H., Mordon S., Collinet P. Traitement des mйtastases pйritonйales des cancers йpithйliaux de l’ovaire par thйrapie photodynamique. Limites et perspectives. Gynecol Obstet Fertil Senolog. 2017;45(4):249–56. DOI: 10.1016/j.gofs.2017.02.005
6. Kim H.I., Wilson B.C. Photodynamic diagnosis and therapy for peritoneal carcinomatosis from gastrointestinal cancers: Status, opportunities, and challenges. J Gastric Cancer. 2020;20(4):355–75. DOI: 10.5230/jgc.2020.20.e39
7. Olszowy M., Nowak-Perlak M., Woźniak M. Current strategies in photodynamic therapy (PDT) and photodynamic diagnostics (PDD) and the future potential of nanotechnology in cancer treatment. Pharmaceutics. 2023;15(6):1712. DOI: 10.3390/pharmaceutics15061712
8. Просветов В.А., Суров Д.А., Гайворонский И.В., Нгуен В.Т. Инновационная технология тотальной париетальной перитонэктомии при карциноматозе брюшины. Известия Российской Военно-медицинской академии. 2022;41(2):143–9. DOI: 10.17816/rmmar104695
9. Kyang L.S., Dewhurst S.L., See V.A., Alzahrani N.A., Morris D.L. Outcomes and prognostic factors of cytoreductive surgery and perioperative intraperitoneal chemotherapy in high-volume peritoneal carcinomatosis. Int J Hyperthermia. 2022;39(1):1106–14. DOI: 10.1080/02656736.2022.2112625
10. Somashekhar S.P., Ashwin K.R., Yethadka R., Zaveri S.S., Ahuja V.K., Rauthan A., et al. Impact of extent of parietal peritonectomy on oncological outcome after cytoreductive surgery and HIPEC. Pleura Peritoneum. 2019;4(4):20190015. DOI: 10.1515/pp-2019-0015
11. Mercier F., Mohamed F., Cazauran J.B., Kepenekian V., Vaudoyer D., Cotte E., et al. An update of peritonectomy procedures used in cytoreductive surgery for peritoneal malignancy. Int J Hyperthermia. 2019;36(1):744–52. DOI: 10.1080/02656736.2019.1635717
12. Sugarbaker P.H. Prevention and treatment of peritoneal metastases: a comprehensive review. Indian J Surg Oncol. 2019;10(1):3–23. DOI: 10.1007/s13193-018-0856-1
13. Liu Y., Endo Y., Fujita T., Ishibashi H., Nishioka T., Canbay E., et al. Cytoreductive surgery under aminolevulinic acid-mediated photodynamic diagnosis plus hyperthermic intraperitoneal chemotherapy in patients with peritoneal carcinomatosis from ovarian cancer and primary peritoneal carcinoma: results of a phase I trial. Ann Surg Oncol. 2014;21(13):4256–62. DOI: 10.1245/s10434-014-3901-5
14. Нгуен В.Т., Просветов В.А., Бромберг Б.Б., Дымников Д.А., Логинов В.А., Демко А.Е. и др. Пути повышения эффективности циторедутивных оперативных вмешательств у больных, страдающих осложненными диссеминированными опухолями брюшной полости и малого таза. Вестник Российской военно-медицинской академии. 2023;25(1):23–32. DOI: 10.17816/brmma120006
15. Нгуен В.Т., Бромберг Б.Б., Новикова М.В., Просветов В.А., Коржук М.С., Демко А.Е. и др. Двухэтапная циторедуктивная хирургия при осложненном прогрессирующем раке тонкой кишки. Вестник Национального медико-хирургического центра им. Н.И. Пирогова. 2022;17(3):142–7. DOI: 10.25881/20728255_2022_17_3_142
16. Панкратов А.А., Сулейманов Э.А., Лукьянец Е.А., Венедиктова Ю.Б., Плютинская А.Д. Экспериментальное обоснование выбора режимов облучения для интраперитонеальной фотодинамической терапии с фотосенсибилизаторами на основе порфиринов и фталоцианинов. Biomedical Photonics. 2017;6(2):12– 20. DOI: 10.24931/2413-9432-2017-6-2-12-20
Об авторах
Д. А. РудаковРоссия
Рудаков Дмитрий Александрович — кафедра военноморской хирургии
Санкт-Петербург
Д. А. Суров
Россия
Суров Дмитрий Александрович — д.м.н., доцент, кафедра военно-морской хирургии
Санкт-Петербург
И. А. Соловьев
Россия
Соловьев Иван Анатольевич — д.м.н., профессор
Санкт-Петербург
О. В. Балюра
Россия
Балюра Олег Валерьевич — к.м.н., кафедра военно-морской хирургии
Санкт-Петербург
Б. Б. Бромберг
Россия
Бромберг Борис Борисович — к.м.н., кафедра военно-морской хирургии
Санкт-Петербург
Н. А. Сизоненко
Россия
Сизоненко Николай Александрович — к.м.н., кафедра военно-морской хирургии
Санкт-Петербург
И. Л. Есаян
Россия
Есаян Игорь Лаврентьевич — кафедра военноморской хирургии
Санкт-Петербург
В. Т. Нгуен
Вьетнам
Нгуен Ван Тху — клиника неотложной помощи
Ханой
Рецензия
Для цитирования:
Рудаков Д.А., Суров Д.А., Соловьев И.А., Балюра О.В., Бромберг Б.Б., Сизоненко Н.А., Есаян И.Л., Нгуен В. Флуоресцентная диагностика и фотодинамическая терапия в циторедуктивном хирургическом лечении больной перитонеальным канцероматозом. Креативная хирургия и онкология. 2024;14(2):186-193. https://doi.org/10.24060/2076-3093-2024-14-2-186-193
For citation:
Rudakov D.A., Surov D.A., Soloviev I.A., Balura O.V., Bromberg B.B., Sizonenko N.A., Esayan I.L., Nguyen V. Fluorescence Diagnostics and Photodynamic Therapy in Cytoreductive Surgical Treatment of Peritoneal Carcinomatosis Patient. Creative surgery and oncology. 2024;14(2):186-193. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-186-193
JATS XML


































