Перейти к:
Наш опыт трансаортального доступа при двухклапанном протезировании
https://doi.org/10.24060/2076-3093-2020-10-4-281-286
Аннотация
Введение. К сочетанным клапанным поражениям относятся поражения более чем одного клапана, что, в свою очередь, может затруднить правильную оценку степени тяжести состояния каждого клапана. Целью исследования стала оценка непосредственных результатов трансаортального протезирования митрального клапана (ТАПМК) при двухклапанном протезировании.
Материал и методы. На ретроспективное исследование были отобраны 19 пациентов, которым было выполнено ТАПМК при двухклапанном протезировании. Средний возраст больных составил 58,0 ± 8,6 года. Мужчин было 10. Сахарный диабет в анамнезе диагностирован у 3 пациентов, фибрилляция предсердий зарегистрирована у 14, ишемическая болезнь сердца — у 2, хроническая обструктивная болезнь легких — у 2, инсульт в анамнезе — у 1 пациента, хроническая сердечная недостаточность III–IV ФК по NYHA — у 19 больных. Инфекционный эндокардит в качестве этиологии порока обнаружен у 4 больных. Двое больных ранее оперированы на сердце. Эхокардиографические параметры: средняя фракция выброса левого желудочка составила 55,0 ± 7,3 %, среднее давление в легочной артерии — 47,0 ± 13,7 мм рт. ст., медиана диаметра фиброзного кольца аортального клапана — 23 (21–25) мм.
Результаты и обсуждение. В 12 случаях были имплантированы механические протезы. Медиана времени операции составила 160 (150–185) мин, среднее время ишемии миокарда (ИМ) — 67,0 ± 9,7 мин, время искусственного кровообращения (ИК) — 87,0 ± 12,5 мин. Рестернотомия по поводу кровотечения выполнялась двум больным, медиана послеоперационной кровопотери составила 300 (212–587) мл. Делирий в раннем послеоперационном периоде развился у 4, острая почечная недостаточность, потребовавшая гемодиализа, отмечалась у 1 больного. Инсульт, периоперационное повреждение миокарда и нарушение проводимости, потребовавшее имплантации электрокардиостимулятора, не отмечены в послеоперационном периоде. Медиана времени искусственной вентиляции легких (ИВЛ) составила 9,5 (6–15) часа, ИВЛ ≥24 часов — у 2. В раннем послеоперационном периоде умер один пациент.
Заключение. ТАПМК при двухклапанном протезировании — безопасная методика с коротким временем ИК, ИМ и длительности операции, которая может быть рекомендована к применению у пациентов с широким фиброзным кольцом АК.
Ключевые слова
Для цитирования:
Чернов И.И., Энгиноев С.Т., Кондратьев Д.А., Зеньков А.А., Тарасов Д.Г. Наш опыт трансаортального доступа при двухклапанном протезировании. Креативная хирургия и онкология. 2020;10(4):281-286. https://doi.org/10.24060/2076-3093-2020-10-4-281-286
For citation:
Chernov I.I., Enginoev S.T., Kondratiev D.A., Ziankou A.A., Tarasov D.G. Original Experience of Transaortic Approach in Bivalve Replacement. Creative surgery and oncology. 2020;10(4):281-286. (In Russ.) https://doi.org/10.24060/2076-3093-2020-10-4-281-286
Введение
К сочетанным клапанным поражениям относятся поражения более чем одного клапана, что, в свою очередь, может затруднить правильную оценку степени тяжести состояния каждого клапана. Показания к операции при сочетанных поражениях аортального и митрального клапанов сердца более подробно расписаны в соответствующих рекомендациях [1][2]. Чаще всего доступ к митральному клапану (МК) осуществляется через левое предсердие (ЛП) в области межпредсердной борозды [3]. Классический биатриальный доступ, описанный Dubost [4], позволяет хорошо визуализировать как МК, так и трикуспидальный клапаны. Еще реже применяется доступ к МК через крышу ЛП, описанный Guiraudon [5]. Трансаортальное протезирование митрального клапана (ТАПМК) впервые было описано Carmichael и его коллегами в 1983 году [6]. Несмотря на теоретические преимущества этого подхода, с тех пор в литературе было зарегистрировано лишь небольшое количество случаев ТАПМК, а конкретные технические аспекты имплантации не детализированы [7][8][9], также была описана упрощенная методика пластики митрального клапана (МК) «край-в-край» через аорту [10], тем не менее ТАПМК остается недостаточно используемым и редко описываемым методом.
Цель исследования: оценить непосредственные результаты трансаортального протезирования митрального клапана (ТАПМК) при двухклапанном протезировании.
Материалы и методы
С апреля 2009 по сентябрь 2019 г. в нашей клинике выполнено 53 ТАПМК. В ретроспективное исследование были отобраны 19 пациентов, которым было выполнено двухклапанное протезирование аортального и митрального клапанов сердца трансаортальным доступом. Средний возраст больных составил 58,0 ± 8,6 года. Мужчин было 10. Сахарный диабет (СД) в анамнезе диагностирован у 3 пациентов, фибрилляция предсердий (ФП) зарегистрирована у 14, ишемическая болезнь сердца (ИБС) — у 2, хроническая обструктивная болезнь легких — у 2, инсульт в анамнезе — у 1 пациента, у всех больных хроническая сердечная недостаточность III-IV ФК по NYHA. Инфекционный эндокардит в качестве этиологии порока обнаружен у 4. Двое больных ранее оперированы на сердце. Эхокардиографические параметры: средняя фракция выброса (ФВ) левого желудочка (ЛЖ) составила 55,0 ± 7,3 %, медиана конечно-диастолического объема левого желудочка (КДО ЛЖ) — 150 (92193) мл, медиана конечно-систолического объема ЛЖ (КСО ЛЖ) — 63 (39-91) мл, среднее давление в легочной артерии — 47,0 ± 13,7 мм рт. ст., медиана диаметра фиброзного кольца аортального клапана (АК) — 23 (2125) мм (данные представлены в таблицах 1 и 2).
Таблица 1. Демографические и дооперационные клинические характеристики пациентов
Table 1. Demographic and preoperative clinical patient profiles
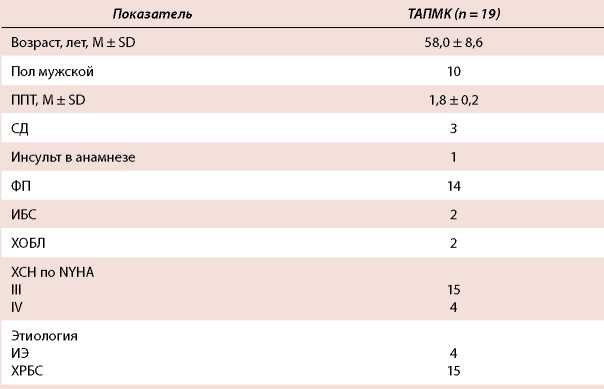
Примечание: ИБС — ишемическая болезнь сердца, ИЭ — инфекционный эндокардит, ППТ — площадь поверхности тела, СД — сахарный диабет, ФП — фибрилляция предсердий, ХРБС — хроническая ревматическая болезнь сердца, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность.
Note: ИБС — ischemic heart disease, ИЭ — infective endocarditis, ППТ — body surface area, СД — diabetes mellitus, ФП — atrial fibrillation, ХРБС — chronic rheumatic heart disease, ХОБЛ — chronic obstructive pulmonary disease, ХСН — chronic heart failure
Таблица 2. Основные дооперационные эхокардиографические показатели
Table 2. Main preoperative echocardiography values
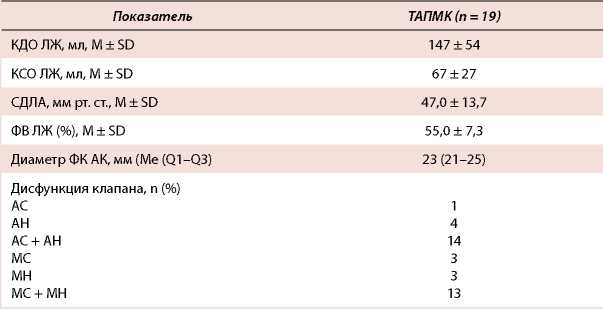
Примечание: АС — аортальный стеноз, АН — аортальная недостаточность, МС — митральный стеноз, МН — митральная недостаточность, ФК АК — фиброзное кольцо аортального клапана, ФВ ЛЖ — фракция выброса левого желудочка, СДЛА — систолическое давление в легочной артерии, КДО ЛЖ — конечно-диастолический объем левого желудочка, КСО ЛЖ — конечно-систолический объем левого желудочка.
Note: АС — aortic stenosis, АН — aortic regurgitation, МС — mitral stenosis, МН — mitral regurgitation, ФК АК — annulus of the aortic valve, ФВ ЛЖ — left ventricular ejection fraction, СДЛА — systolic pressure in the pulmonary artery, КДО ЛЖ — end-diastolic volume of the left ventricle, КСО ЛЖ — end-systolic volume of the left ventricle.
Критерии включения:
- ТАПМК при двухклапанном протезировании АК и МК,
- пациенты старше 18 лет.
Критерии исключения:
- гемодинамически значимое поражение коронарных артерий,
- поражение других клапанов (кроме АК и МК) и аорты, требующее вмешательств,
- процедура «Maze».
Хирургическая техника
Вводный наркоз и поддержание анестезии не отличались от стандартных операций на сердце. Всем пациентам до начала разреза и после завершения операции выполнялась интраоперационная чреспищеводная эхокардиография (ЧПЭ). Операции выполнялись в условиях ИК с нормотермической перфузией и фармакохолодовой кардиоплегией раствором «Кустодиол». Аппарат ИК в основном подключался по схеме «аорта — полые вены», при повторных вмешательствах по схеме — «аорта — правое предсердие». После аортотомии створки АК иссекались и при необходимости выполнялась декальцинация. Через фиброзное кольцо АК осуществлялась ревизия МК, как правило, створки были изменены, что требовало иссечения створок. После резекции
МК определяли размер протеза стандартным способом при помощи «сайзеров». В отличие от стандартного метода имплантации протеза отдельными П-образными швами, при ТАПМК применяли методику имплантации протеза непрерывным швом. После имплантации протеза в митральную позицию выполняли имплантацию протеза в аортальную позицию отдельными П-образными или непрерывными швами.
Статистический анализ
Статистическая обработка материала выполнялась с использованием пакета программного обеспечения IBM SPSS Statistics 26 (Chicago, IL, USA). Выполнена проверка всех количественных переменных на тип распределения с помощью критерия Шапиро — Уилка, графически — с помощью квантильных диаграмм, а также показателей асимметрии и эксцесса. Центральные тенденции и рассеяния количественных признаков, имеющие приближенно нормальное распределение, описывали в форме среднего значения (стандартного отклонения); в случае отличного от нормального распределения — в виде медианы (интерквартильный размах 25-й и 75-й процентили).
Результаты
В 12 случаях были имплантированы механические протезы. Медиана времени операции составила 160 (150-185) мин, среднее время ишемии миокарда (ИМ) — 67,0 ± 9,7 мин, время искусственного кровообращения — 87,0 ± 12,5 мин. Рестернотомия по поводу кровотечения выполнялась двум больным, медиана послеоперационной кровопотери составила 300 (212587) мл. Делирий в раннем послеоперационном периоде развился у 4, острая почечная недостаточность (ОПН), потребовавшая гемодиализа, отмечалась у 1 пациента. Такие осложнения, как инсульт, периоперационное повреждение миокарда и нарушение проводимости, потребовавшее имплантации ЭКС, не отмечены в периоперационном периоде. Медиана времени искусственной вентиляции легких (ИВЛ) составила 9,5 (6-15) часа, ИВЛ >24 часов — у 2 (10,5 %) больных. В раннем послеоперационном периоде умер один пациент. Данные представлены в таблицах 3 и 4.
Таблица 3. Интраоперационные показатели
Table 3. Intraoperative values
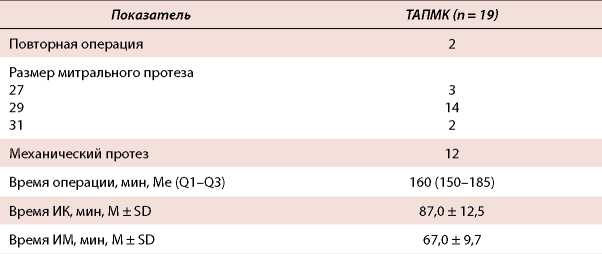
Примечание: ИК — искусственное кровообращение, ИМ — ишемия миокарда.
Note: ИК — artificial blood circulation, ИМ — myocardial ischemia.
Таблица 4. Ранние послеоперационные показатели и осложнения
Table 4. Early postoperative values and complications

Примечание: ВАБК — внутриаортальная баллонная контрпульсация, ИВЛ — искусственная вентиляция легких, ОПН — острая почечная недостаточность, ЭКС — электрокардиостимулятор, ЭКМО — экстракорпоральная мембранная оксигенация.
Note: ВАБК — intra-aortic balloon counterpulsation, ИВЛ — artificial ventilation of the lungs, ОПН — acute renal failure, ЭКС — pacemaker, ЭКМО — extracorporeal membrane oxygenation.
Обсуждение
На сегодня медиана госпитальной летальности после двухклапанного протезирования АК и МК составляет 9 % [11]. H. Okuyama и соавт. сравнили обычный доступ с расширением корня аорты по Manouguian при двухклапанном протезировании АК и МК: авторами было показано, что процедура Manouguian не увеличивала госпитальную и среднесрочную летальность, поскольку выживаемость через 8 лет составила 83 % в группе Manouguian и 84 % в контрольной группе (р = 0,82), а частота отсутствия событий через 8 лет составила 79 % в группе Manouguian и 84 % в контрольной группе (р = 0,6) [12]. ТАПМК во время протезирования АК впервые описано Carmichael и его коллегами в 1983 году [6]. Этот доступ был первоначально применен для больных с ИЭ аортального и митрального клапанов. В нашем исследовании в качестве этиологии ИЭ диагностирован у 4 больных. Имеются работы применения такого доступа при пластических операциях на МК [13][14][15][16], при декальцификации МК во время протезирования АК через мини-доступ [17], при миоэктомии и пластике МК по Альфиери у больных с ГКМП и SAM-синдроме [18]. Несмотря на теоретические преимущества такого доступа, в литературе имеется очень ограниченное количество случаев применения этого доступа при ТАПМК [7][8][9][19]. Wen-Jian Jiang и соавт. [20] сравнили трансаортальный и транссептальный доступы при хирургии МК у больных с митральной регургитацией и аневризмой восходящей аорты, в результате сравнения выяснено, что время ИК и ИМ были статистически значимо меньше в группе с трансаортальным доступом.
Трансаортальный доступ при протезировании МК имеет ряд потенциальных преимуществ по сравнению с традиционными межпредсердными доступами. Во-первых, использование одного только трансаортального доступа при ТАПМК устраняет необходимость в дополнительных доступах, что, в свою очередь, сокращает время ИК и ИМ. Время ИК и ИМ является факторами, увеличивающими госпитальную летальность [21][22] риск развития ОПН [23][24]. Длительность ИК > 180 мин была статистическим значимым фактором для прогнозирования летальности, послеоперационных осложнений, длительности пребывания в реанимации и искусственной вентиляции легких [25]. Среднее время ИК и ИМ в нашем исследовании составило 87,0 ± 12,5 и 67,0 ± 9,7 мин соответственно. При ревизии МК через трансаортальный доступ отсутствует избыточная ретракция ЛП, что уменьшает риск повреждения стенок предсердия. Кроме того, отсутствуют дополнительные линии шва, что также снижает риск послеоперационного кровотечения. В нашем исследовании медиана послеоперационной кровопотери составила 300 (213587) мл. Доступ имеет определенную привлекательность для пациентов, которым хирургическое вмешательство выполняется через мини-доступ [10][26], и при повторных вмешательствах, поскольку устраняется необходимость полного кардиолиза правого предсердия.
Заключение
Трансаортальное протезирование митрального клапана при двухклапанном протезировании — безопасная методика с коротким временем ИК, ИМ и длительности операции, которая может быть рекомендована к применению у пациентов с широким фиброзным кольцом АК.
Список литературы
1. Baumgartner H., Falk V., Bax J.J., De Bonis M., Hamm C., Holm P.J., et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38(36):2739–91. DOI: 10.1093/eurheartj/ehx391
2. Writing Committee Members, Otto C.M., Nishimura R.A., Bonow R.O., Carabello B.A., Erwin J.P. 3rd, Gentile F., et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2020:S0735-1097(20)37902-X. DOI: 10.1016/j.jacc.2020.11.035
3. Sondergaard T., Gotzsche H., Ottosen P., Schultz J. Surgical closure of interatrial septal defects by circumclusion. Acta Chir Scand. 1955;109:188–96. PMID: 13248393
4. Dubost C., Guilmet D., de Parades B., Pedeferri G. New technic of opening of the left auricle in open-heart surgery: the transseptal biauricular approach. Presse Med. 1966;74:1607–8. PMID: 5932446
5. Guiraudon G.M., Ofiesh J.G., Kaushik R. Extended vertical transatrial septal approach to the mitral valve. Ann Thorac Surg. 1991;52:1058–62. DOI: 10.1016/0003-4975(91)91281-y
6. Carmichael M.J., Cooley D.A., Favor A.S. Aortic and mitral valve replacement through a single transverse aortotomy: a useful approach in difficult mitral valve exposure. Tex Heart Inst J. 1983;10:415–9. PMID: 15226977
7. Crawford E.S., Coselli J.S. Marfan’s syndrome: combined composite valve graft replacement of the aortic root and transaortic mitral valve replacement. Ann Thorac Surg. 1988;45:296–302. DOI: 10.1016/s0003-4975 (10) 62466-6
8. Najafi H., Hemp J.R. Mitral valve replacement through the aortic root. J Thorac Cardiovasc Surg. 1994;107:1334–6. DOI: 10.1016/S0022-5223(94)70055-9
9. Abraham S., Joshi R., Kumar A.S. Transaortic double valve replacement with total chordal preservation. Tex Heart Inst J. 2002;29:133–5. PMID: 12075872
10. Santana O., Lamelas J. Minimally invasive transaortic mitral valve repair during aortic valve replacement. Tex Heart Inst J. 2011;38:298–300. PMID: 21720478
11. Writing Committee Members, Otto C.M., Nishimura R.A.,
12. Bonow R.O., Carabello B.A., Erwin J.P. 3rd, Gentile F., et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2020;S0735-1097(20)37796-2. DOI: 10.1016/j.jacc.2020.11.018.
13. Okuyama H., Hashimoto K., Kurosawa H., Tanaka K., Sakamoto Y., Shiratori K. Midterm results of Manouguian double valve replacement: Comparison with standard double valve replacement. J Thorac Cardiovasc Surg. 2005;129:869–74. DOI: 10.1016/j.jtcvs.2004.10.026
14. Mihos C.G., Larrauri-Reyes M., Hung J., Santana O. Transaortic edge-to-edge repair for functional mitral regurgitation during aortic valve replacement: A 13-year experience. Innovations (Phila). 2016;11(6):425–9. DOI: 10.1097/IMI.0000000000000306
15. Çiloğlu U., Aldağ M., Albeyoğlu Ş., Kutlu H., Karakaya C. Transaortic repair of concomitant mitral insufficiency in patients with critical aortic stenosis undergoing aortic valvular replacement. Turk Gogus Kalp Damar Cerrahisi Derg. 2019;27:9–14. DOI: 10.5606/tgkdc.dergisi.2019.16105
16. Santana O., Panchamukhi K.B., Grana R., Traad E.A. Transaortic repair of the mitral valve in patients undergoing aortic valve replacement. Heart Surg Forum. 2009;12:E320–3. DOI: 10.1532/HSF98.20091056
17. Mihos C.G., Xydas S., Nappi F., Santana O. Transaortic alfieri repair for secondary mitral regurgitation: effective and underused. Ann Thorac Surg. 2018;106:1264. DOI: 10.1016/j.athoracsur.2018.04.077
18. Totsugawa T., Sakaguchi T., Hiraoka A., Matsushita H., Hirai Y., Yoshitaka H. Minimally invasive transaortic mitral decalcification during aortic valve replacement. Innovations (Phila). 2015;10:288–90. DOI: 10.1097/IMI.0000000000000174
19. Shah A.A., Glower D.D., Gaca J.G. Trans-aortic Alfieri stitch at the time of septal myectomy for hypertrophic obstructive cardiomyopathy. J Card Surg. 2016;31:503–6. DOI: 10.1111/jocs.12804
20. Салагаев Г.И., Лысенко А.В., Леднев П.В., Белов Ю.В. Трансаортальное протезирование митрального клапана у больного с сочетанным клапанным поражением. Хирургия. 2018;(5):106–7. DOI: 10.17116/hirurgia20185106-107
21. Jiang W.J., Ma W.G., Wang X.L., Liu Y.Y., Zhu J.M., Sun L.Z., et al. Surgery for mitral regurgitation in patients with aortic root aneurysm: Transaortic or transseptal approach? Int J Cardiol. 2016;223:1059–65. DOI: 10.1016/j.ijcard.2016.08.258
22. Kumar A., Anstey C., Tesar P., Shekar K. Risk factors for mortality in patients undergoing cardiothoracic surgery for infective endocarditis. Ann Thorac Surg. 2019;108:1101–6. DOI: 10.1016/j.athoracsur.2019.05.029
23. Al-Sarraf N., Thalib L., Hughes A., Houlihan M., Tolan M., Young V., et al. Cross-clamp time is an independent predictor of mortality and morbidity in low- and high-risk cardiac patients. Int J Surg. 2011;9:104–9. DOI: 10.1016/j.ijsu.2010.10.007
24. Taniguchi F.P., De Souza A.R., Martins A.S. Cardiopulmonary bypass time as a risk factor for acute renal failure. Braz J Cardiovasc Surg. 2007;22:201–5. DOI: 10.1590/S0102-76382007000200008
25. Axtell A.L., Fiedler A.G., Melnitchouk S., D’Alessandro D.A., Villavicencio M.A., Jassar A.S., et al. Correlation of cardiopulmonary bypass duration with acute renal failure after cardiac surgery. J Thorac Cardiovasc Surg. 2019:S0022-5223(19)30286-7. DOI: 10.1016/j.jtcvs.2019.01.072
26. Madhavan S., Chan S.-P., Tan W.-C., Eng J., Li B., Luo H.-D., et al. Cardiopulmonary bypass time: every minute counts. J Cardiovasc Surg (Torino). 2018;59:274–81. DOI: 10.23736/S0021-9509.17.09864-0
27. Чернов И.И., Макеев С.А., Козьмин Д.Ю., Тарасов Д.Г. Коррекция многоклапанных пороков сердца из мини-доступа. Клиническая и экспериментальная хирургия. 2018;6(1):21–6.
Об авторах
И. И. ЧерновРоссия
к.м.н., зам. главного врача по хирургии
Астрахань
С. Т. Энгиноев
Россия
кардиохирургическое отделение № 3, консультативно-диагностическое отделение, кафедра сердечно-сосудистой хирургии факультета последипломного образования
Астрахань
Д. А. Кондратьев
Россия
кардиохирургическое отделение № 1
Астрахань
А. А. Зеньков
Россия
д.м.н.
Астрахань
Д. Г. Тарасов
Россия
к.м.н., главный врач
Астрахань
Рецензия
Для цитирования:
Чернов И.И., Энгиноев С.Т., Кондратьев Д.А., Зеньков А.А., Тарасов Д.Г. Наш опыт трансаортального доступа при двухклапанном протезировании. Креативная хирургия и онкология. 2020;10(4):281-286. https://doi.org/10.24060/2076-3093-2020-10-4-281-286
For citation:
Chernov I.I., Enginoev S.T., Kondratiev D.A., Ziankou A.A., Tarasov D.G. Original Experience of Transaortic Approach in Bivalve Replacement. Creative surgery and oncology. 2020;10(4):281-286. (In Russ.) https://doi.org/10.24060/2076-3093-2020-10-4-281-286


































