Перейти к:
Механизмы метастазирования в позвоночник: новые перспективы
https://doi.org/10.24060/2076-3093-2024-14-2-163-173
Аннотация
Метастазы являются ключевым механизмом распространения злокачественных опухолей, при котором клетки опухоли отделяются от первичного очага и формируют новые опухолевые узлы в различных частях организма. Костная ткань, включая позвоночник, часто поражается метастазами, что может значительно ухудшить прогноз и качество жизни пациентов. Метастазирование представляет собой сложный многоэтапный процесс, в ходе которого клетки опухоли претерпевают молекулярные и фенотипические изменения, позволяющие им мигрировать и адаптироваться к новым условиям в организме. Костные метастазы могут быть остеолитическими, вызывающими разрушение костей, или остеобластными, стимулирующими избыточное формирование костной ткани. Опухолевые клетки, попадая в кость, активируют остеокласты или остеобласты, что приводит к перестройке костной ткани и образованию замкнутого цикла разрушения костей и роста опухоли. Особенности опухолевых клеток определяются их генетическими и эпигенетическими изменениями, а также взаимодействием с окружающей средой. Понимание молекулярных и патофизиологических аспектов метастазирования в позвоночнике играет ключевую роль в разработке эффективных методов лечения и улучшении подходов к терапии. В данной работе рассматриваются новые терапевтические подходы, направленные на преодоление метастазирования в позвоночник с целью улучшения прогноза и качества жизни пациентов.
Ключевые слова
Для цитирования:
Бейлерли О.А., Гареев И.Ф., Павлов В.Н., Мусаев Э.Р., Чмутин Г.Е., Вонг Ч. Механизмы метастазирования в позвоночник: новые перспективы. Креативная хирургия и онкология. 2024;14(2):163-173. https://doi.org/10.24060/2076-3093-2024-14-2-163-173
For citation:
Beylerli O.A., Gareev I.F., Pavlov V.N., Musaev E.R., Chmutin G.E., Wang C. Mechanisms of Spinal Metastases: New Perspectives. Creative surgery and oncology. 2024;14(2):163-173. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-163-173
ВВЕДЕНИЕ
От 20 до 50 % пациентов со злокачественными опухолями сталкиваются с метастазами в позвоночнике [1]. Период между возникновением первичной опухоли и появлением метастазов в позвоночнике зависит от типа и расположения исходного новообразования. Исследования показывают, что 80 % метастазов в позвоночнике исходят из четырех основных видов карцином: рак молочной железы (РМЖ), рак легких, рак предстательной железы (РПЖ) и почечноклеточный рак (ПКР) [2][3]. РМЖ — самый распространенный источник костных метастазов среди женщин, причем у 65–85 % женщин с РМЖ обнаруживаются метастазы в кости [2][3]. Среди мужчин метастазы чаще всего вызывает рак легких и РПЖ [2][3]. Злокачественные опухоли костей позвоночника у детей, такие как остеосаркома, саркома Юинга, лимфома и метастатическая нейробластома, встречаются редко, но для эффективного лечения требуют быстрой диагностики. Достижения в области визуализации, хирургических методов, лучевой и химиотерапии улучшили показатели выживаемости и снизили частоту рецидивов, особенно при опухолях низкой степени злокачественности. Однако прогноз остается очень плохим для опухолей высокой степени злокачественности с отдаленными метастазами. Раннее выявление и направление в специализированные онкологические центры имеют решающее значение для оптимизации результатов лечения пациентов [4]. Риск развития метастазов в позвоночнике увеличивается с возрастом пациента, длительностью с момента диагностики первичного заболевания и наличием других заболеваний [1].
Механизмы формирования метастазов в позвоночнике включают перенос опухолевых клеток из первичного очага, их установление в позвоночнике и последующий рост метастатической опухоли [5–7]. Для начала опухолевые клетки должны преодолеть барьеры внутри первичной опухоли и строму. Уменьшение уровня экспрессии различных адгезионных молекул позволяет этим клеткам отделяться и формировать опухолевые эмболы, которые далее могут проникать в кровеносные сосуды для транспортировки по организму. Эти клетки также должны уклоняться от иммунной системы. Если опухолевые клетки успешно преодолеют эти препятствия, они могут начать метастазировать в позвоночник и разрастаться в костном мозге. Венозные, артериальные и лимфатические системы служат основными маршрутами метастазирования в позвоночник. Опухолевые клетки, проникающие в кость, активизируют выработку ростовых факторов, стимулирующих остеобластические или остеолитические процессы. Множество молекул, включая матриксные металлопротеиназы (ММР), протеогликаны, интерлейкины, трансформирующий фактор роста-β (TGF-β) и сосудистый эндотелиальный фактор роста (VEGF), участвуют в этих процессах, но понимание молекулярно-биологических механизмов метастазирования в позвоночник все еще недостаточно и требует дальнейших исследований [5–7]. В данной работе рассматриваются ключевые патофизиологические механизмы, задействованные в распространении метастазов в позвоночник, и предлагаются новые терапевтические подходы, такие как генная терапия, влияющая на регуляцию сигнальных путей и генов в данном патологическом процессе.
РЕМОДЕЛИРОВАНИЕ КОСТНОЙ ТКАНИ В НОРМЕ
Кость является активной тканью, регулируемой множеством факторов, и содержит два ключевых типа клеток: остеобласты и остеокласты. Остеобласты — это специализированные клетки, формирующие кость, происходящие из мезенхимальных стволовых клеток (МСК). Они способствуют выработке факторов, стимулирующих остеокласты, и производят костный матрикс. Некоторые остеобласты трансформируются в остеоциты внутри костного матрикса, которые действуют как механосенсоры, стимулирующие ремоделирование кости путем активации остеобластов и остеокластов [8][9]. Остеоциты — это древние клетки, обнаруженные в костях ранних рыб и динозавров, они широко распространены, но недостаточно изучены в биологии позвоночных. Эти клетки встроены в кость и могут модифицировать окружающий ее матрикс посредством механизмов, отличных от механизмов остеобластов и остеокластов. Они связываются с другими костными клетками через сигнальные пути, такие как RankL/OPG и Sost/Dkk1/Wnt. Кроме того, остеоциты действуют как эндокринные клетки, влияющие на функции почек, поджелудочной железы и мышц, и чувствительны к механическим раздражителям, помогая адаптировать структуру кости для удовлетворения механических потребностей [10][11]. Ремоделирование кости является жизненно важным процессом для поддержания здоровья костей взрослого человека, включающим как фазы костеобразования, так и фазы резорбции. Равновесие между этими фазами имеет решающее значение для поддержания костной массы и общего минерального баланса в организме (рис. 1) [11][12]. Апоптоз остеоцитов уменьшает выработку TGF-β, подавляющего остеокластогенез. Мононуклеарные предшественники моноцитов, макрофаги и остеокласты привлекаются и активизируются остеобластными клетками через цитокины RANKL и M–CSF, связанные с образованием остеокластов [11][12].
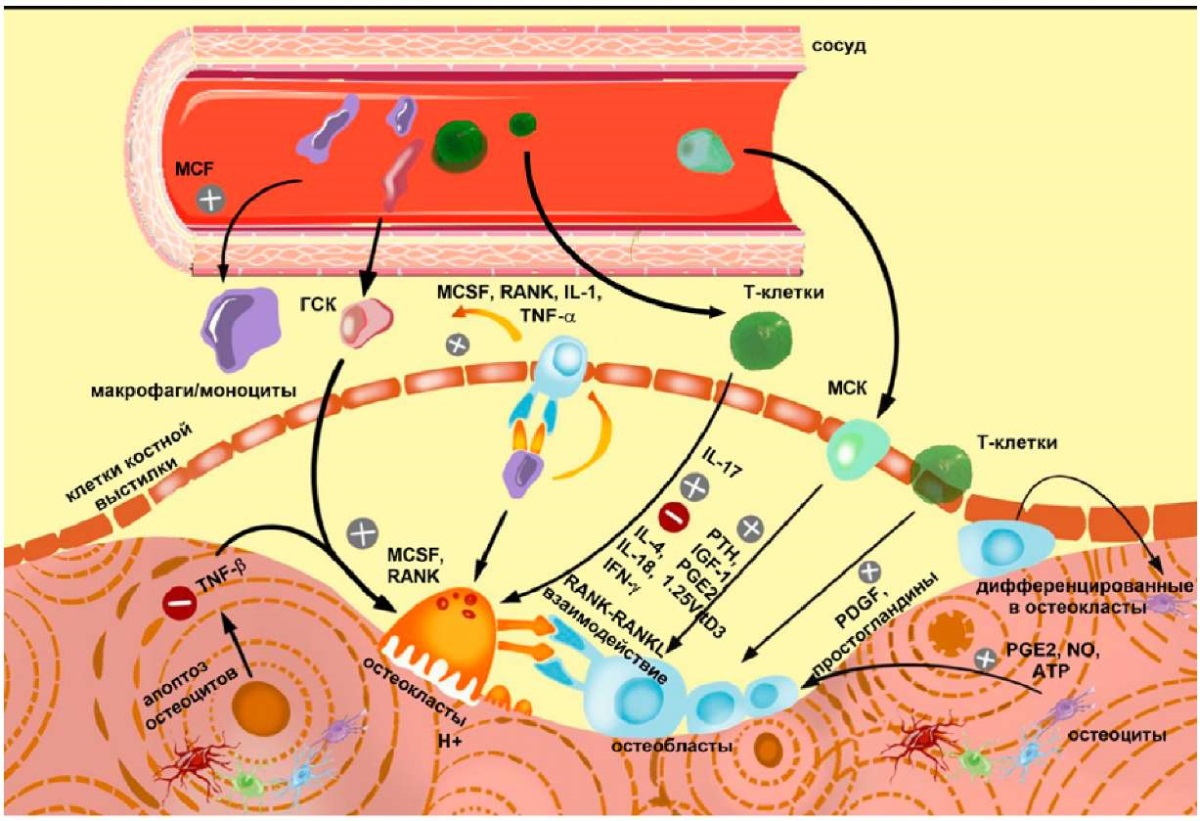
Рисунок 1. Механизм ремоделирования костной ткани в норме. Процесс, инициируемый остеобластами, которые происходят из плюрипотентных мезенхимальных стволовых клеток по пути Wnt/β-катенин и стимулируются такими гормонами, как паратиреоидный гормон (ПТГ). Эти клетки играют роль в формировании кости, тогда как остеокласты, происходящие из мононуклеарных предшественников, активированных колониестимулирующим фактором макрофагов (M–CSF) и рецептор-активатором лиганда NF-κB (RANKL), ответственны за резорбцию кости. В ответ на повреждение кости остеоциты модулируют активность остеокластов, изменяя секрецию цитокинов и факторов роста, что дополнительно влияет на резорбцию и формирование кости. Цикл завершается переходом некоторых остеобластов в остеоциты или выстилающие клетки, которые регулируют темпы формирования кости, излучая тормозные сигналы
Figure 1. The mechanism of normal bone tissue remodelling. A process is initiated by osteoblasts, derived from pluripotent mesenchymal stem cells through the Wnt/в-catenin pathway and stimulated by hormones such as parathyroid hormone (PTH). These cells matter in bone formation, while osteoclasts, derived from mononuclear progenitors activated by macrophage colony-stimulating factor (M–CSF) and receptor activator of NF-кB ligand (RANKL), are responsible for bone resorption. In response to bone damage, osteocytes modulate osteoclast activity by altering the secretion of cytokines and growth factors, thereby affecting bone resorption and formation. The cycle ends with the transition of some osteoblasts to osteocytes or lining cells, which regulate the rate of bone formation by emitting inhibitory signals
Гормоны, включая паратиреоидный гормон (ПТГ), эстроген и кальцитонин, существенно влияют на процесс ремоделирования костей. ПТГ влияет на здоровье костей посредством множества клеточных и молекулярных процессов. Постоянное воздействие высоких уровней ПТГ обычно приводит к чистой потере костной массы, хотя и ускоряет костеобразование остеобластами. Напротив, периодическое использование аналогов ПТГ является единственным одобренным FDA анаболическим лечением остеопороза, которое увеличивает костную массу [13]. Моноцитарный хемоаттрактантный белок-1 (MCP-1), также известный как CCL2, является ключевым медиатором воспаления, который привлекает различные иммунные клетки, такие как моноциты и Т-клетки, и играет решающую роль во многих заболеваниях. Он действует посредством хемокинового рецептора-2 (CCR2) с мотивом CC, участвуя в хемотаксической активности и увеличивая приток кальция. В скелетной системе на экспрессию CCL2 влияют множество факторов, включая гормоны и цитокины, а его взаимодействие с CCR2 запускает несколько важных сигнальных путей, таких как PI3K/Akt/ERK/NF-κB. Понимание динамики CCL2 и CCR2 может привести к новым методам лечения воспалительных и скелетных заболеваний, таких как ревматоидный артрит и остеолиз [14]. В этих условиях происходит уменьшение производства остеопротегерина (OPG), рецептора-ловушки для RANKL, который ингибирует остеокластогенез. Параллельно увеличивается синтез M–CSF и RANKL, что усиливает формирование остеокластов [15].
Остеоциты, служащие механосенсорными клетками в костях, играют ключевую роль в регуляции образования остеокластов посредством экспрессии рецептора-активатора лиганда ядерного фактора κΒ (RANKL), который жизненно важен для развития остеокластов как в нормальных, так и в патологических условиях. Отмечается, что присутствие цитокинов, таких как TNF-α, усиливает экспрессию RANKL в остеоцитах, тем самым способствуя образованию остеокластов. Кроме того, TNF-α также усиливает экспрессию склеростина, что еще больше способствует активности остеокластов [16]. В одном из исследований изучается влияние механического стресса на периодонтальную связку (PDL) у молодых мышей, уделяя особое внимание биомолекулярным изменениям в пространствах PDL, которые расширяются или сужаются в результате движения зубов. Используя механическое тестирование и рентгеновскую микрокомпьютерную томографию, исследование подчеркивает деформацию кровеносных сосудов и активное ремоделирование на границах раздела PDL-кость и PDL-цемент, отмеченное присутствием ключевых белков, таких как остерикс, костный сиалопротеин и другие.
Исследование также выявило совместную локализацию нервных пучков с многоядерными клетками и сосудистыми структурами, что указывает на механизм управляемой нервами остеокластической активности, необходимой для ремоделирования. Эти результаты подчеркивают потенциал целевых фармакологических вмешательств для манипулирования положением зубов путем изменения механической нагрузки, которая влияет на динамику минералов в энтезисе, тем самым способствуя регенерации тканей и ортодонтической корректировке [17]. После резорбции поврежденного костного материала мононуклеарные реверсивные клетки вступают в процесс, обеспечивающий переход от резорбции к формированию кости. В фазе формирования кости мезенхимальные стволовые клетки (МСК) набираются и дифференцируются в остеобласты под воздействием местных ростовых факторов и гормонов. Ключевые идентифицированные молекулярные игроки включают ядерные рецепторы и факторы транскрипции, такие как рецептор γ, активирующий пролифератор пероксисом (PPARγ) и эстрогенсвязанный рецептор α (ERRα), а также их кофактор транскрипции, коактиватор PPARγ 1-β (PGC-1β), а также метаболические и трансмембранные компоненты, такие как НАДН: убихиноноксидоредуктаза, железо-серный белок 4 (Ndufs4) и рецептор липопротеинов очень низкой плотности (VLDLR). Эти молекулы помогают стимулировать дифференцировку остеокластов, одновременно подавляя воспалительную активность макрофагов.
Эта сложная регуляция предлагает новое понимание взаимодействия между врожденным иммунитетом и ремоделированием костей [18]. Гибель скелетных клеток, таких как хондроциты, остеобласты и остеоциты, играет решающую роль как в нормальном функционировании, так и в нарушениях скелетной системы, влияя на развитие, поддержание и восстановление, а также способствуя таким заболеваниям, как остеоартрит и остеопороз. Ключевые регуляторные процессы включают апоптоз этих клеток, который оказывает значительное влияние на динамику костей. Остеоциты также участвуют в этом процессе, выделяя простагландин E2 (PGE2), оксид азота (NO) и АТФ для стимуляции остеобластов [11][19]. Этот сложный баланс гибели клеток и регуляторных механизмов влияет на целостность скелета и патогенез заболеваний скелета. В итоге устанавливается динамичный баланс между активностью остеокластов и остеобластов, поддерживающий постепенную резорбцию и формирование кости. В здоровом состоянии микроокружение кости постоянно поддерживает этот баланс, однако метастатические поражения могут нарушить систему RANK/OPG, что приводит к повышенной резорбции кости и местному воспалению [20 –22].
ОСОБЕННОСТИ МЕТАСТАТИЧЕСКОГО ПОРАЖЕНИЯ ПОЗВОНОЧНИКА
Около 70 % симптоматических метастатических поражений позвоночника выявляются в грудном отделе и 20 % в поясничном [1]. Исследование, проведенное Jaffe и коллегами, показало, что более 70 % пациентов, умерших от злокачественных опухолей, имели метастазы в позвоночнике, преимущественно в грудном его отделе [23]. В то же время другие исследования выявили частое поражение поясничного отдела позвоночника. Шейный отдел редко рассматривался в крупных исследованиях как локализация метастаз, что связано с его относительно низкой частотой поражения [24]. Более половины пациентов с метастазами в позвоночнике страдают от множественных поражений. От 10 до 38 % пациентов имеют множественные поражения несмежных сегментов [25][26]. Gilbert и его коллеги обнаружили, что при метастазировании РМЖ и рака легких чаще всего поражается грудной отдел позвоночника [27]. Однако метастазы могут распространяться на весь позвоночник. РПЖ обычно поражает поясничный отдел позвоночника, крестец и таз.
ПУТИ РАСПРОСТРАНЕНИЯ ОТ ПЕРВИЧНОГО ОЧАГА К ПОЗВОНОЧНИКУ
Имеются четыре основных маршрута метастазирования в позвоночник: венозный, артериальный, лимфатический и прямой. Наиболее часто метастазы в позвоночник происходят через венозную систему. Опухолевые эмболы, которые представляют собой скопления опухолевых клеток, для закрепления в костномозговых пространствах позвоночника должны преодолеть капиллярные сети печени и легких. В процессе этого перемещения часто формируются дополнительные метастатические очаги в этих органах [28][29].
Венозное распространение
После поступления артериальной крови в позвоночник она отводится через крупную центральную базивертебральную вену и множество меньших параартикулярных вен. Обычно от 5 до 10 % кровотока через портальную и полые системы перенаправляется в позвоночные венозные системы. Эти венозные пути связаны с эпидуральным венозным сплетением, системой без клапанов в позвоночном канале, которую Бэтсон первым предложил как возможный маршрут метастазов в позвоночник [30]. Венозное сплетение Бэтсона находится в эпидуральном пространстве между позвоночником и твердой мозговой оболочкой, охватывающей спинной мозг, и соединено с основными венами, ведущими венозную кровь обратно к сердцу, включая верхнюю и нижнюю полые вены. Отсутствие клапанов в этом сплетении позволяет обратному кровотоку увеличиваться при повышении давления в системе полых вен [31][32]. Исследования Бэтсона in vivo подтвердили, что эпидуральное венозное сплетение является потенциальной дорогой для метастазирования раковых клеток в позвоночник [32].
Артериальное распространение
Артериальное распространение также является одним из путей метастатического поражения позвоночника. Опухолевые эмболы могут передвигаться по артериальной системе и достигать позвонков через артерии, которые их снабжают. К примеру, клетки рака легких могут непосредственно поражать позвоночник через сегментарные артерии, что считается распространенным маршрутом метастазирования для этого вида рака [33].
Прямое воздействие
Прямое проникновение метастазов также рассматривается как возможный путь распространения при РПЖ или раке легких. Опухоли, находящиеся в забрюшинном пространстве или средостении, могут прорастать напрямую в тела позвонков или проникать в спинномозговой канал через межпозвоночные отверстия вдоль периферических нервов. Это помогает объяснить, почему РПЖ чаще метастазирует в кости таза и поясничный отдел позвоночника, в то время как рак легких и РМЖ чаще поражают грудной отдел [33][34].
Лимфатическое распространение
Еще одним путем метастазирования в позвоночник является лимфогенный путь. Хотя с помощью лимфангиографии можно обнаружить лимфатические каналы в костях, их роль как пути для распространения злокачественных опухолей до конца не установлена [35].
МЕХАНИЗМ ЛОКАЛИЗАЦИИ МЕТАСТАТИЧЕСКИХ ПОРАЖЕНИЙ
Метастазирование в позвоночник — это многогранный процесс, при котором опухолевые клетки перемещаются из первичного очага поражения в позвоночник, включающий несколько важных этапов. Первоначально опухолевые клетки пролиферируют в пределах первичного опухолевого участка. По мере их роста уменьшение количества молекул клеточной адгезии позволяет этим клеткам отделяться от основной опухолевой массы. Впоследствии они проникают в близлежащие кровеносные сосуды, прорывая базальную пластинку и эндотелий, которые являются структурными барьерами кровеносных сосудов. Попав в кровоток, эти опухолевые клетки циркулируют, пока не достигнут области позвоночника. Там они начинают процесс колонизации и пролиферации в пространствах костного мозга, создавая новые места роста опухоли [36].
Эти процессы в значительной степени происходят благодаря активности протеиназ, включая ММР, сериновые, цистеиновые и аспарагиновые протеиназы, стромелизин и урокиназный тип активатора плазминогена (uPA). Эти ферменты разрушают базальную мембрану и окружающие ткани, деградируя такие компоненты, как коллаген IV типа, ламинин и протеогликаны, а также влияют на межклеточную адгезию, модифицируя клеточные адгезивные рецепторы [37][38]. Инвазивные свойства опухолевых клеток также связаны с изменениями в экспрессии интегринов, кадгеринов, иммуноглобулинов и селектинов, включая снижение экспрессии E-кадгерина и повышение экспрессии CD44 [39]. Костный мозг создает уникальную микросреду, которая поддерживает колонизацию опухолей, особенно на поздних стадиях рака, таких как рак молочной железы, простаты и легких. Взаимодействие между опухолевыми клетками и динамической средой костного мозга, включая такие процессы, как кроветворение, остеогенез и иммунные реакции, способствует метастазированию в кости. Эти взаимодействия происходят в специализированных тканевых нишах, которые регулируют поведение опухолевых клеток, такое как засев, покой и рост [40].
Преимущество метастатических поражений в областях скелета с красным костным мозгом, таких как тела позвонков, ребра, подвздошные кости, грудина, головка бедренной кости и эпифизы длинных костей, может быть объяснено богатой васкуляризацией этих областей. Это облегчает транспортировку опухолевых клеток в указанные части скелета, а снижение скорости кровотока и образование микротромбов способствуют их адгезии и фиксации на сосудистом эндотелии [25]. Согласно другой теории, опухолевые клетки мигрируют и обосновываются в определенных тканях, потому что именно там создаются условия, благоприятные для их роста. В этом помогают факторы роста, цитокины, ферменты и гормоноподобные вещества, присутствующие в костной ткани и костном мозге, которые в сочетании с аналогичными факторами, вырабатываемыми самими опухолевыми клетками, создают подходящую микросреду для имплантации и развития метастазов [41][42].
Ферменты, такие как MMP, костный сиалопротеин (BSP) и остеопонтин (OPN), играют важную роль в имплантации опухолевых клеток в костный мозг, разрушая внеклеточный матрикс и модифицируя клеточные и клеточно-матричные взаимодействия, что стимулирует ангиогенез [43]. После того как опухолевые клетки укореняются в костномозговых пространствах, развитие метастатических опухолей и проявление клинических симптомов, таких как болевой синдром, зависят от множества факторов, включая взаимодействие с окружающей костью и клетками костного мозга, уровень экспрессии молекул адгезии, доступность пространства, степень васкуляризации и тип ремоделирования костной ткани [43].
ОСТЕОЛИТИЧЕСКИЕ И ОСТЕОБЛАСТИЧЕСКИЕ МЕТАСТАЗЫ
Основными видами метастатических поражений костной ткани являются остеолитический (остеокластический) и остеобластический типы, каждый из которых характеризуется преобладанием активности соответствующего типа клеток. В обоих случаях происходит нарушение равновесия между процессами формирования новой кости и ее резорбции [44]. Несмотря на этот дисбаланс, существует все больше данных, указывающих на частое сочетание остеолитических и остеобластных метастазов, приводящее к формированию смешанного типа поражений костной ткани. Согласно анализу биохимических маркеров метаболизма костной ткани, метастазы в костях от рака легкого обычно имеют остеолитический характер, в то время как РПЖ чаще вызывает остеобластические метастазы [45]. Процессы развития остеокластических и остеобластных метастазов костной ткани представлены на рисунке 2.
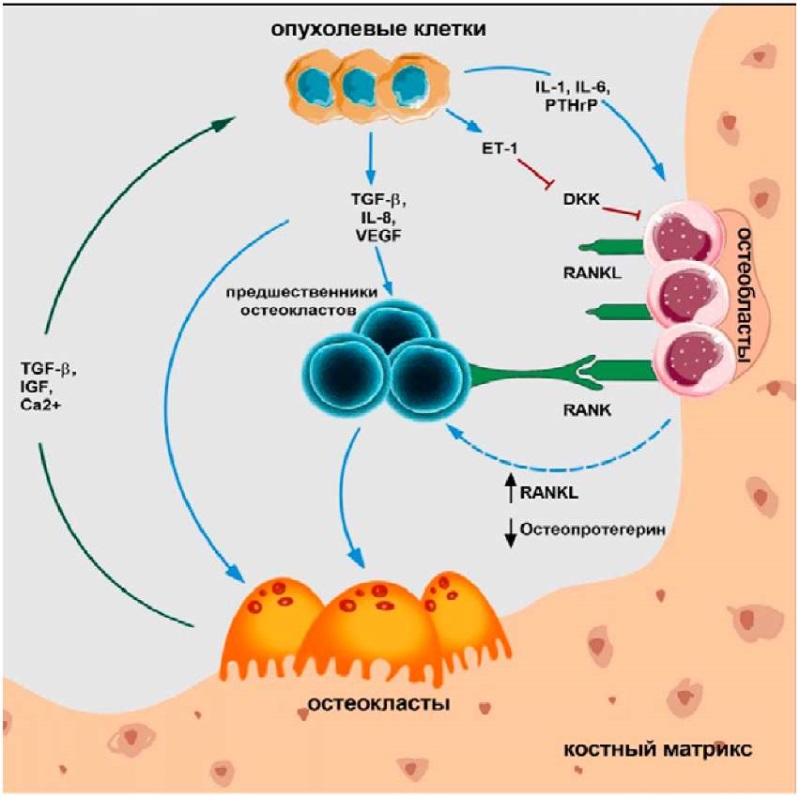
Рисунок 2. Развитие остеокластических и остеобластных типов метастатических повреждений костной ткани. Опухолевые клетки взаимодействуют с остеокластами и остеобластами в костной ткани, вызывая местное усиление выработки факторов, которые стимулируют развитие остеокластов и остеобластов. В ответ на это зрелые остеокласты выделяют факторы, способствующие выживанию клеток, такие как инсулиноподобный фактор роста 1 (IGF-1) и трансформирующий фактор роста бета (TGF-β), что поддерживает выживаемость и пролиферацию опухолевых клеток
Figure 2. Development of osteoclastic and osteoblastic types of metastatic bone tissue damage. Tumor cells interact with osteoclasts and osteoblasts in bone tissue, causing a local increase in the production of factors that stimulate the development of osteoclasts and osteoblasts. In response, mature osteoclasts release cell prosurvival factors such as insulin-like growth factor 1 (IGF-1) and transforming growth factor beta (TGF-в), thereby supporting tumor cell survival and proliferation
Механизмы остеолитических метастазов
Рак молочной железы — это наиболее частая причина остеолитических метастазов в костной ткани [46]. Остеокласты, происходящие из миелоидного ряда, являются критически важными клетками, ответственными за резорбцию кости как при физиологических, так и при патологических состояниях. Их дифференциация от миелоидных предшественников включает взаимодействие между различными рецепторами и лигандами, включая CSF-1R с M–CSF, RANK с RANKL и интегрины с их лигандами. Эти клетки играют центральную роль в развитии таких заболеваний, как остеопороз, ревматоидный артрит и остеолиз, индуцированный раковыми клетками. Недавние исследования подчеркнули значительную роль нерецепторных тирозинкиназ и липидкиназ в активности остеокластов, указывая на ингибиторы низкомолекулярных киназ как на перспективные методы лечения заболеваний, связанных с патологической потерей костной массы. В частности, было показано, что липидкиназы, такие как PI3Kβ и PI3Kδ, наряду с тирозинкиназами, такими как Src-семейство и Syk, играют решающую роль в дифференцировке и функционировании остеокластов [47]. В частности, высокие уровни белка, ассоциированного с паратиреоидным гормоном (PTHrP), являются ключевым фактором в развитии остеолитических поражений, особенно в местах метастазирования. Экспрессия PTHrP в метастазах костной ткани значительно выше, чем в метастазах мягких тканей или в первичной опухоли [48][49].
В исследовании Zheng и др. изучается влияние общих флавоноидов шлемника бородчатого D. Don (TF-SB) на метастазы карциномы молочной железы в кости, уделяя особое внимание остеолитическим процессам, запускаемым опухолевыми факторами, такими как белок, родственный паратиреоидному гормону (ПТГрП), рецептор-активатор ядерного лиганд фактора-κB (RANKL) и остеопротегерин (OPG). Используя клеточные линии MDA-MB-231 и модели голых мышей, исследователи продемонстрировали, что TF-SB ингибирует пролиферацию, миграцию и инвазию раковых клеток дозозависимым образом. Кроме того, было показано, что TF-SB снижает активность остеокластов и контролирует секрецию связанных с остеолизом факторов PTHrP и RANKL/OPG, эффективно предотвращая метастазирование в кости, не влияя на размер опухоли или выживаемость мышей [50].
Активация сигналов через RANKL участвует в дифференцировке предшественников остеокластов через такие факторы транскрипции, как NF-κB и AP1, а также через активацию Jun N-концевой киназы (JNK), экстрацеллюлярно регулируемых киназ 1/2 (Erk1/2) и митоген-активируемой протеинкиназы p38, что приводит к резорбции костной ткани [22][51]. Когда костная ткань резорбируется, активируются ростовые факторы, такие как TGF-β, PDGF, IGF-1, кальций (Ca2+) и фактор роста фибробластов (FGF), создавая замкнутый цикл, способствующий дальнейшему развитию метастатических поражений остеолитического типа [52]. Высвобождение TGF-β из минерализованного костного матрикса поддерживает активность опухоли и местную пролиферацию опухолевых клеток, активируя рецептор TGF-beta RII и регуляторные белки Smad [53–55]. Также TGF-β угнетает пролиферацию Т-клеток и активность NK-клеток, подавляя иммунную систему. Опухолевые клетки, активированные TGF-β, демонстрируют усиленную пролиферацию и продукцию PTHrP, а также усиленную инвазию и метастазирование благодаря взаимодействию с тромбоцитами, которые высвобождают TGF-β [56][57]. Эти процессы представляют собой «порочный круг», ломка которого может предложить новые возможности для терапии. Ингибирование TGF-β с помощью ингибиторов рецептора I TGF-β уже показало уменьшение роста опухоли и метастазирования в предыдущих исследованиях, что подчеркивает необходимость дальнейших исследований в этом направлении [58].
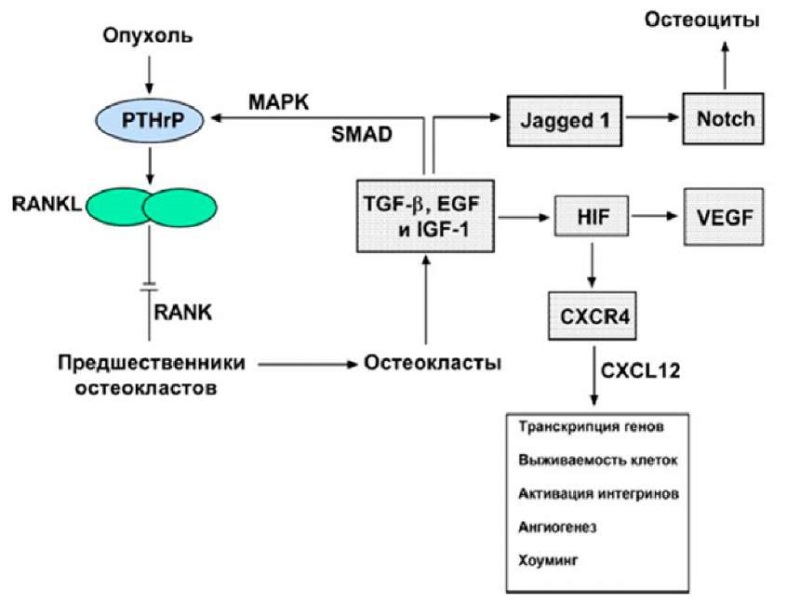
Рисунок 3. Взаимодействия между опухолью и остеокластами
Белок, связанный с паратиреоидным гормоном (PTHrP), производимый опухолевыми клетками, стимулирует экспрессию RANKL на остеобластах и других стромальных клетках через рецептор паратиреоидного гормона 1. RANKL взаимодействует с рецептором RANK на остеокластах, что приводит к их активации и последующей резорбции кости. Этот процесс вызывает высвобождение ростовых факторов, таких как TGF-β, EGF и IGF-1, которые дополнительно усиливают продукцию PTHrP. TGF-β также активирует сигнальные пути Smad и MAPK, увеличивает активность Jagged1, ведущего к активации пути Notch в остеоцитах, и стимулирует выработку VEGF и CXCR4 под действием HIF.
Figure 3. Interactions between tumor and osteoclasts
Parathyroid hormone-related protein (PTHrP), produced by tumor cells, stimulates the expression of RANKL on osteoblasts and other stromal cells through parathyroid hormone receptor 1. RANKL interacts with the RANK receptor on osteoclasts, leading to their activation and subsequent bone resorption. This process causes the release of growth factors such as TGF-в, EGF and IGF-1 to further enhance PTHrP production. TGF-в also activates the Smad and MAPK signalling pathways, increases the activity of Jagged1 leading to activation of the Notch pathway in osteocytes, and stimulates the production of VEGF and CXCR4 by HIF
Механизмы остеобластических метастазов
Остеобластические метастазы представляют собой сложный процесс, в котором опухолевые клетки взаимодействуют с костной микросредой, активно изменяя ее через ряд молекулярных и клеточных механизмов [59–61]. Этот процесс начинается с того, что опухолевые клетки секретируют различные факторы роста, такие как эндотелин-1 (ET-1), TGF-β, IGF-1, FGF, PDGF и Wnt [62–64]. Эти факторы активируют остеобласты, стимулируя их пролиферацию и дифференциацию, что ведет к усиленному формированию костной ткани на местах метастазов. Эндотелин-1 особенно значим в контексте остеобластических метастазов. Он действует как мощный митоген для остеобластов и усиливает передачу сигналов через сигнальные пути Wnt за счет подавления DKK-1, антагониста Wnt-пути [65–67]. Такое подавление приводит к усилению остеобластной активности и ускорению формирования новой костной ткани в зонах метастазирования. Сериновая протеаза калликреина, известная как простат-специфический антиген (ПСА), также играет ключевую роль в регуляции микросреды костной ткани [68–70]. ПСА, выделяемый опухолевыми клетками, расщепляет белки, подавляя активность остеокластов, что снижает резорбцию кости и одновременно стимулирует остеобласты к высвобождению факторов роста, таких как IGF-1 и TGF-β, которые усиливают их дифференциацию и пролиферацию.
Протеаза uPA, выполняющая функции медиатора, контролирует пролиферацию опухолевых клеток и активацию остеокластов, поддерживая динамичный баланс между разрушением и формированием костной ткани. Эти механизмы подчеркивают сложность взаимодействий между опухолевыми клетками, остеобластами и остеокластами, формируя циклы активации и подавления, которые определяют прогрессирование остеобластических метастазов [71][72].
Понимание этих взаимодействий предоставляет новые возможности для разработки целенаправленных терапевтических стратегий, направленных на корректировку метастатической активности и поддержку костной структуры, что может значительно улучшить прогноз и качество жизни пациентов с метастазами в кости. Эти данные подчеркивают значимость микроокружения метастатической опухоли для развития остеобластных метастатических поражений костной ткани, что иллюстрировано на рисунке 4.

Рисунок 4. Взаимодействия между опухолью и остеобластами. Опухолевые клетки способствуют формированию остеобластов, вырабатывая стимулирующие факторы, такие как костный морфогенетический белок (BMP), фактор роста фибробластов (FGF) и субъединица B фактора роста из тромбоцитов (PDGF). Эти факторы, принадлежащие к семейству TGF-β, активизируют дифференцировку мезенхимальных стволовых клеток в остеобласты через факторы транскрипции, такие как Runx2. Кроме того, опухолевые клетки активируют эндотелин 1 (ET-1), который не только стимулирует активность остеобластов, но и усиливает действие других факторов роста, включая IGF-1 и PDGF. Активированные остеобласты вырабатывают важные цитокины, такие как IL-6 и VEGF, способствуя колонизации и росту опухолей в костной ткани.
Figure 4. Interactions between tumor and osteoblasts. Tumor cells promote the formation of osteoblasts by producing stimulating factors such as bone morphogenetic protein (BMP), fibroblast growth factor (FGF), and platelet-derived growth factor subunit B (PDGF). These factors, belonging to the TGF-в family, activate the differentiation of mesenchymal stem cells into osteoblasts through transcription factors such as Runx2. In addition, tumor cells activate endothelin 1 (ET-1), stimulating osteoblast activity and enhancing the action of other growth factors, including IGF-1 and PDGF. Activated osteoblasts produce important cytokines such as IL-6 and VEGF, promoting the colonization and growth of tumors in bone tissue
РОЛЬ ИММУННОЙ СИСТЕМЫ
Известно, что метастатические поражения позвоночника инициируют воспалительные процессы, привлекая Т-лимфоциты и макрофаги, которые инфильтрируют опухоль [73]. Исследования указывают, что Т-клетки могут регулировать рост опухолевых клеток в костях, не завися от их взаимодействия с клетками самой костной ткани. В костном мозге пациентов с РМЖ обнаруживаются Т-клетки памяти, что предполагает их возможную роль в иммунном контроле над опухолью [74]. Активированные Т-клетки усиливают выработку RANKL, что напрямую способствует развитию остеокластов [75]. У пациентов с костными метастазами, включая позвоночник, предшественники остеокластов могут дифференцироваться в зрелые остеокласты в присутствии Т-клеток даже без M–CFS и RANKL, в то время как деплеция Т-клеток препятствует образованию зрелых остеокластов [75][76]. Также Т-клетки стимулируют выработку интерлейкина-7 (IL-7), который оказывает двойное воздействие на остеокласты, усиливая продукцию RANKL и фактора некроза опухоли (TNF) из Т-клеток, что способствует формированию зрелых остеокластов [77]. Клетки Th17, специфическое подмножество Т-хелперов, секретируют TGF и TNF, активируя остеокласты и стимулируя резорбцию кости, тем самым поддерживая замкнутый цикл роста метастатической опухоли в позвоночнике [78]. Требуются дополнительные исследования для определения роли различных подмножеств Т-клеток в механизме метастазирования в позвоночник.
Механизмы метастазирования в позвоночнике включают в себя сложные взаимодействия между опухолевыми клетками и различными компонентами иммунной системы, включая клетки-супрессоры миелоидного происхождения (MDSC), которые играют центральную роль в этом процессе [79–81]. MDSC представляют собой разнообразную группу патологически активированных миелоидных клеток с иммуносупрессивными свойствами. Они формируются из незрелых миелоидных клеток под воздействием различных цитокинов и факторов роста. Когда опухоль формируется, MDSC могут активироваться и подавлять иммунный ответ, способствуя выживанию и распространению опухолевых клеток [82][83]. Эти клетки обладают способностью подавлять активность естественных киллеров (NK) и цитотоксических Т-лимфоцитов (CD8+) через различные механизмы, такие как выработка аргиназы, индуцибельной синтазы оксида азота (iNOS), TGF-β, IL-10 и цистеина [83–85]. Более того, MDSC способствуют формированию опухолевого микроокружения и поддержанию метастазов. Они могут создавать «предметастатическую нишу», привлекаясь к будущим местам метастазирования под воздействием факторов роста и цитокинов, выделяемых первичными опухолевыми клетками [86]. После формирования предметастатической ниши MDSC взаимодействуют с опухолевыми клетками, стимулируя их пролиферацию и ЭМП, что способствует агрессивному развитию метастазов. Таким образом, патологически активированные миелоидные клетки, особенно MDSC, играют важную роль в метастазировании в позвоночнике, подавляя иммунный ответ и способствуя формированию и распространению опухолевых очагов. Понимание этих механизмов может предложить новые перспективы для разработки терапевтических стратегий, направленных на управление иммунным ответом и предотвращение метастазирования в позвоночнике.
ЗАКЛЮЧЕНИЕ
Метастазирование в позвоночнике представляет собой сложный процесс, который включает несколько фаз, начиная с колонизации и заканчивая активным ростом опухоли. Несмотря на значительные успехи в области консервативного и хирургического лечения метастатических поражений позвоночника, остаются серьезные проблемы и вопросы, которые мешают достижению высокой эффективности терапии. В контексте микроокружения первичной опухоли клетки-супрессоры миелоидного происхождения (MDSC) играют важнейшую роль в подавлении иммунного ответа, обеспечивая уклонение опухолевых клеток от атак иммунной системы. Их иммуносупрессивная функция включает подавление активности Т-лимфоцитов и натуральных киллеров (NK-клеток), что способствует распространению метастазов на отдаленные участки. Механизмы, позволяющие опухолевым клеткам уклоняться от иммунного ответа, остаются недостаточно изученными, однако их понимание представляет собой перспективу для идентификации новых целей для терапевтического вмешательства. Подробное изучение молекулярных и клеточных механизмов на разных этапах развития опухоли является важным направлением будущих исследований, которое может привести к разработке эффективных методов профилактики и лечения метастатических поражений позвоночника, улучшая исходы для пациентов. Таким образом, интегрированное понимание молекулярных, клеточных и иммунологических механизмов метастазирования в позвоночнике открывает новые перспективы для разработки инновационных стратегий лечения и повышения качества жизни пациентов, страдающих от метастатических поражений позвоночника.
Список литературы
1. Wu M.Y., Li C.J., Yiang G.T., Cheng Y.L., Tsai A.P., Hou Y.T., et al. Molecular regulation of bone metastasis pathogenesis. Cell Physiol Biochem. 2018;46(4):1423–38. DOI: 10.1159/000489184
2. McCabe F.J., Jadaan M.M., Byrne F., Devitt A.T., McCabe J.P. Spinal metastasis: The rise of minimally invasive surgery. Surgeon. 2021:S1479-666X(21)00140-2. DOI: 10.1016/j.surge.2021.08.007
3. Luksanapruksa P., Buchowski J.M., Hotchkiss W., Tongsai S., Wilartratsami S., Chotivichit A. Prognostic factors in patients with spinal metastasis: a systematic review and meta-analysis. Spine J. 2017;17(5):689–708. DOI: 10.1016/j.spinee.2016.12.003
4. Kim H.J., McLawhorn A.S., Goldstein M.J., Boland P.J. Malignant osseous tumors of the pediatric spine. J Am Acad Orthop Surg. 2012;20(10):646–56. DOI: 10.5435/JAAOS-20-10-646
5. Patnaik S., Turner J., Inaparthy P., Kieffer W.K. Metastatic spinal cord compression. Br J Hosp Med (Lond). 2020;81(4):1–10. DOI: 10.12968/hmed.2019.0399
6. Choi D., Bilsky M., Fehlings M., Fisher C., Gokaslan Z. Spine oncology-metastatic spine tumors. Neurosurgery. 2017;80(3S):S131–7. DOI: 10.1093/neuros/nyw084
7. Challapalli A., Aziz S., Khoo V., Kumar A., Olson R., Ashford R.U., et al. Spine and non-spine bone metastases — current controversies and future direction. Clin Oncol (R Coll Radiol). 2020;32(11):728–44. DOI: 10.1016/j.clon.2020.07.010
8. Katsimbri P. The biology of normal bone remodelling. Eur J Cancer Care (Engl). 2017;26(6). DOI: 10.1111/ecc.12740 9 Mizoguchi T., Ono N. The diverse origin of bone-forming osteoblasts. J Bone Miner Res. 2021;36(8):1432–47. DOI: 10.1002/jbmr.4410
9. Kim J.M., Lin C., Stavre Z., Greenblatt M.B., Shim J.H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 2020;9(9):2073. DOI: 10.3390/cells9092073
10. Robling A.G., Bonewald L.F. The osteocyte: new insights. Annu Rev Physiol. 2020;82:485–506. DOI: 10.1146/annurev-physiol-021119-034332
11. Zalfa C., Paust S. Natural killer cell interactions with myeloid derived suppressor cells in the tumor microenvironment and implications for cancer immunotherapy. Front Immunol. 2021;12:633205. DOI: 10.3389/fimmu.2021.633205
12. Wein M.N., Kronenberg H.M. Regulation of bone remodeling by parathyroid hormone. Cold Spring Harb Perspect Med. 2018;8(8):a031237. DOI: 10.1101/cshperspect.a031237
13. Zhu S., Liu M., Bennett S., Wang Z., Pfleger K.D.G., Xu J. The molecular structure and role of CCL2 (MCP-1) and C-C chemokine receptor CCR2 in skeletal biology and diseases. J Cell Physiol. 2021;236(10):7211–22. DOI: 10.1002/jcp.30375
14. Udagawa N., Koide M., Nakamura M., Nakamichi Y., Yamashita T., Uehara S., et al. Osteoclast differentiation by RANKL and OPG signaling pathways. J Bone Miner Metab. 2021;39(1):19–26. DOI: 10.1007/s00774-020-01162-6
15. Kitaura H., Marahleh A., Ohori F., Noguchi T., Shen W.R., Qi J., et al. Osteocyte-related cytokines regulate osteoclast formation and bone resorption. Int J Mol Sci. 2020;21(14):5169. DOI: 10.3390/ijms21145169
16. Yang L., Kang M., He R., Meng B., Pal A., Chen L., et al. Microanatomical changes and biomolecular expression at the PDL-entheses during experimental tooth movement. J Periodontal Res. 2019;54(3):251–8. DOI: 10.1111/jre.12625
17. Yang D., Wan Y. Molecular determinants for the polarization of macrophage and osteoclast. Semin Immunopathol. 2019;41(5):551–63. DOI: 10.1007/s00281-019-00754-3
18. De Cicco P., Ercolano G., Ianaro A. The new era of cancer immunotherapy: targeting myeloid-derived suppressor cells to overcome immune evasion. Front Immunol. 2020;11:1680. DOI: 10.3389/fimmu.2020.01680
19. Li X., Liu Y., Wu B., Dong Z., Wang Y., Lu J., et al. Potential role of the OPG/RANK/RANKL axis in prostate cancer invasion and bone metastasis. Oncol Rep. 2014;32(6):2605–11. DOI: 10.3892/or.2014.3511
20. Deligiorgi M.V., Panayiotidis M.I., Griniatsos J., Trafalis D.T. Harnessing the versatile role of OPG in bone oncology: counterbalancing RANKL and TRAIL signaling and beyond. Clin Exp Metastasis. 2020;37(1):13–30. DOI: 10.1007/s10585-019-09997-8
21. Takegahara N., Kim H., Choi Y. RANKL biology. Bone. 2022;159:116353. DOI: 10.1016/j.bone.2022.116353
22. Jaffee W.F. Tumors and tumorous conditions of the bones and joints. Philadelphia, PA: Lea and Febiger; 1958.
23. Gao Z.Y., Zhang T., Zhang H., Pang C.G., Xia Q. Effectiveness of preoperative embolization in patients with spinal metastases: a systematic review and meta-analysis. World Neurosurg. 2021;152:e745–57. DOI: 10.1016/j.wneu.2021.06.062
24. Perrin R.G., Laxton A.W. Metastatic spine disease: epidemiology, pathophysiology, and evaluation of patients. Neurosurg Clin N Am. 2004;15(4):365–73. DOI: 10.1016/j.nec.2004.04.018
25. Nater A., Sahgal A., Fehlings M. Management — spinal metastases. Handb Clin Neurol. 2018;149:239–55. DOI: 10.1016/B978-0-12- 811161-1.00016-5
26. Gilbert R.W., Kim J.H., Posner J.B. Epidural spinal cord compression from metastatic tumor: diagnosis and treatment. Ann Neurol. 1978;3(1):40–51. DOI: 10.1002/ana.410030107
27. Turajlic S., Swanton C. Metastasis as an evolutionary process. Science. 2016;352(6282):169–75. DOI: 10.1126/science.aaf2784
28. Hofbauer L.C., Bozec A., Rauner M., Jakob F., Perner S., Pantel K. Novel approaches to target the microenvironment of bone metastasis. Nat Rev Clin Oncol. 2021;18(8):488–505. DOI: 10.1038/s41571-021-00499-9
29. Santos J.L.M., Kalhorn S.P. Anatomy of the posterolateral spinal epidural ligaments. Surg Neurol Int. 2021;12:33. DOI: 10.25259/SNI_894_2020
30. Nathoo N., Caris E.C., Wiener J.A., Mendel E. History of the vertebral venous plexus and the significant contributions of Breschet and Batson. Neurosurgery. 2011;69(5):1007–14; disc. 1014. DOI: 10.1227/NEU.0b013e3182274865
31. Onuigbo W.I. Batson’s theory of vertebral venous metastasis: a review. Oncology. 1975;32(3–4):145–50. DOI: 10.1159/000225060. PMID: 1221328
32. Wu S., Pan Y., Mao Y., Chen Y., He Y. Current progress and mechanisms of bone metastasis in lung cancer: a narrative review. Transl Lung Cancer Res. 2021;10(1):439–51. DOI: 10.21037/tlcr-20-835
33. Sturge J., Caley M.P., Waxman J. Bone metastasis in prostate cancer: emerging therapeutic strategies. Nat Rev Clin Oncol. 2011;8(6):357–68. DOI: 10.1038/nrclinonc.2011.67
34. Spano D., Heck C., De Antonellis P., Christofori G., Zollo M. Molecular networks that regulate cancer metastasis. Semin Cancer Biol. 2012;22(3):234–49. DOI: 10.1016/j.semcancer.2012.03.006
35. Satcher R.L., Zhang X.H. Evolving cancer-niche interactions and therapeutic targets during bone metastasis. Nat Rev Cancer. 2022;22(2):85– 101. DOI: 10.1038/s41568-021-00406-5 37 Raubenheimer E.J., Noffke C.E. Pathogenesis of bone metastasis: a review. J Oral Pathol Med. 2006;35(3):129–35. DOI: 10.1111/j.1600-0714.2006.00360.x
36. Joyce J.A., Pollard J.W. Microenvironmental regulation of metastasis. Nat Rev Cancer. 2009;9(4):239–52. DOI: 10.1038/nrc2618
37. Liu Y., Qing H., Su X., Wang C., Li Z., Liu S. Association of CD44 gene polymorphism with survival of NSCLC and risk of bone metastasis. Med Sci Monit. 2015;21:2694–700. DOI: 10.12659/MSM.894357
38. Chen F., Han Y., Kang Y. Bone marrow niches in the regulation of bone metastasis. Br J Cancer. 2021;124(12):1912–20. DOI: 10.1038/s41416-021-01329-6
39. Clézardin P., Coleman R., Puppo M., Ottewell P., Bonnelye E., Paycha F., et al. Bone metastasis: mechanisms, therapies, and biomarkers. Physiol Rev. 2021;101(3):797–855. DOI: 10.1152/physrev.00012.2019
40. Fornetti J., Welm A.L., Stewart S.A. Understanding the bone in cancer metastasis. J Bone Miner Res. 2018;33(12):2099–113. DOI: 10.1002/jbmr.3618
41. Eleraky M., Papanastassiou I., Vrionis F.D. Management of metastatic spine disease. Curr Opin Support Palliat Care. 2010;4(3):182–8. DOI: 10.1097/SPC.0b013e32833d2fdd
42. Kaur M., Nagpal M., Singh M. Osteoblast-n-Osteoclast: making headway to osteoporosis treatment. Curr Drug Targets. 2020;21(16):1640– 51. DOI: 10.2174/1389450121666200731173522
43. Zhang X. Interactions between cancer cells and bone microenvironment promote bone metastasis in prostate cancer. Cancer Commun (Lond). 2019;39(1):76. DOI: 10.1186/s40880-019-0425-1
44. Tahara R.K., Brewer T.M., Theriault R.L., Ueno N.T. Bone metastasis of breast cancer. Adv Exp Med Biol. 2019;1152:105–29. DOI: 10.1007/978-3-030-20301-6_7
45. Győri D.S., Mócsai A. Osteoclast signal transduction during bone metastasis formation. Front Cell Dev Biol. 2020;8:507. DOI: 10.3389/fcell.2020.00507
46. Zhang R., Li J., Assaker G., Camirand A., Sabri S., Karaplis A.C., et al. Parathyroid hormone-related protein (PTHrP): an emerging target in cancer progression and metastasis. Adv Exp Med Biol. 2019;1164:161– 78. DOI: 10.1007/978-3-030-22254-3_13
47. Edwards C.M., Johnson R.W. From good to bad: the opposing effects of PTHrP on tumor growth, dormancy, and metastasis throughout cancer progression. Front Oncol. 2021;11:644303. DOI: 10.3389/fonc.2021.644303
48. Zheng X., Kang W., Liu H., Guo S. Inhibition effects of total flavonoids from Sculellaria barbata D. Don on human breast carcinoma bone metastasis via downregulating PTHrP pathway. Int J Mol Med. 2018;41(6):3137–46. DOI: 10.3892/ijmm.2018.3515
49. Okamoto K. Role of RANKL in cancer development and metastasis. J Bone Miner Metab. 2021;39(1):71–81. DOI: 10.1007/s00774-020-01182-2
50. David Roodman G., Silbermann R. Mechanisms of osteolytic and osteoblastic skeletal lesions. Bonekey Rep. 2015;4:753. DOI: 10.1038/bonekey.2015.122
51. Fang J., Xu Q. Differences of osteoblastic bone metastases and osteolytic bone metastases in clinical features and molecular characteristics. Clin Transl Oncol. 2015;17(3):173–9. DOI: 10.1007/s12094-014-1247-x
52. Buijs J.T., Stayrook K.R., Guise T.A. The role of TGF-β in bone metastasis: novel therapeutic perspectives. Bonekey Rep. 2012;1:96. DOI: 10.1038/bonekey.2012.96
53. Syed V. TGF-β signaling in cancer. J Cell Biochem. 2016;117(6):1279– 87. DOI: 10.1002/jcb.25496
54. Trivedi T., Pagnotti G.M., Guise T.A., Mohammad K.S. The role of TGF-β in bone metastases. Biomolecules. 2021;11(11):1643. DOI: 10.3390/biom11111643
55. Tiedemann K., Hussein O., Komarova S.V. Role of altered metabolic microenvironment in osteolytic metastasis. Front Cell Dev Biol. 2020;8:435. DOI: 10.3389/fcell.2020.00435
56. Teicher B.A. TGFβ-directed therapeutics: 2020. Pharmacol Ther. 2021;217:107666. DOI: 10.1016/j.pharmthera.2020.107666
57. Wan L., Pantel K., Kang Y. Tumor metastasis: moving new biological insights into the clinic. Nat Med. 2013;19(11):1450–64. DOI: 10.1038/nm.3391
58. Weidle U.H., Birzele F., Kollmorgen G., Rüger R. Molecular mechanisms of bone metastasis. Cancer Genomics Proteomics. 2016;13(1):1– 12. PMID: 26708594
59. Loreth D., Schuette M., Zinke J., Mohme M., Piffko A., Schneegans S., et al. CD74 and CD44 expression on CTCs in cancer patients with brain metastasis. Int J Mol Sci. 2021;22(13):6993. DOI: 10.3390/ijms22136993
60. Miwa S., Mizokami A., Keller E.T., Taichman R., Zhang J., Namiki M. The bisphosphonate YM529 inhibits osteolytic and osteoblastic changes and CXCR-4-induced invasion in prostate cancer. Cancer Res. 2005;65(19):8818–25. DOI: 10.1158/0008-5472.CAN-05-0540
61. Wang J., Loberg R., Taichman R.S. The pivotal role of CXCL12 (SDF-1)/CXCR4 axis in bone metastasis. Cancer Metastasis Rev. 2006;25(4):573–87. DOI: 10.1007/s10555-006-9019-x
62. Cheng X., Wang Z. Immune modulation of metastatic niche formation in the bone. Front Immunol. 2021;12:765994. DOI: 10.3389/fimmu.2021.765994
63. Mohammad K.S., Guise T.A. Mechanisms of osteoblastic metastases: role of endothelin-1. Clin Orthop Relat Res. 2003;(415 Suppl):S67–74. DOI: 10.1097/01.blo.0000093047.96273.4e
64. Tocci P., Blandino G., Bagnato A. YAP and endothelin-1 signaling: an emerging alliance in cancer. J Exp Clin Cancer Res. 2021;40(1):27. DOI: 10.1186/s13046-021-01827-8
65. Clines G.A., Mohammad K.S., Bao Y., Stephens O.W., Suva L.J., Shaughnessy J.D. Jr, et al. Dickkopf homolog 1 mediates endothelin1-stimulated new bone formation. Mol Endocrinol. 2007;21(2):486–98. DOI: 10.1210/me.2006-0346
66. Leth J.M., Ploug M. Targeting the urokinase-type plasminogen activator receptor (uPAR) in human diseases with a view to non-invasive imaging and therapeutic intervention. Front Cell Dev Biol. 2021;9:732015. DOI: 10.3389/fcell.2021.732015
67. Sabur V., Untan I., Tatlisen A. Role of PSA kinetics in hormone-refractory prostate cancer. J Coll Physicians Surg Pak. 2021;30(6):673–8. DOI: 10.29271/jcpsp.2021.06.673
68. Chaoying L., Chao M., Xiangrui Y., Yingjian H., Gang Z., Yunhan R., et al. Risk factors of bone metastasis in patients with newly diagnosed prostate cancer. Eur Rev Med Pharmacol Sci. 2022;26(2):391–8. DOI: 10.26355/eurrev_202201_27863
69. Kaplan Z., Zielske S.P., Ibrahim K.G., Cackowski F.C. Wnt and β-Catenin signaling in the bone metastasis of prostate cancer. Life (Basel). 2021;11(10):1099. DOI: 10.3390/life11101099
70. Supsavhad W., Hassan B.B., Simmons J.K., Dirksen W.P., Elshafae S.M., Kohart N.A., et al. Effect of Dickkopf-1 (Dkk-1) and SP600125, a JNK inhibitor, on Wnt signaling in canine prostate cancer growth and bone metastases. Vet Sci. 2021;8(8):153. DOI: 10.3390/vetsci8080153
71. Cai X., Luo J., Yang X., Deng H., Zhang J., Li S., et al. In vivo selection for spine-derived highly metastatic lung cancer cells is associated with increased migration, inflammation and decreased adhesion. Oncotarget. 2015;6(26):22905–17. DOI: 10.18632/oncotarget.4416
72. Kfoury Y., Baryawno N., Severe N., Mei S., Gustafsson K., Hirz T., et al. Human prostate cancer bone metastases have an actionable immunosuppressive microenvironment. Cancer Cell. 2021;39(11):1464–78.e8. DOI: 10.1016/j.ccell.2021.09.005
73. Weitzmann M.N. Bone and the immune system. Toxicol Pathol. 2017;45(7):911–24. DOI: 10.1177/0192623317735316
74. Okamoto K., Takayanagi H. Osteoimmunology. Cold Spring Harb Perspect Med. 2019;9(1):a031245. DOI: 10.1101/cshperspect.a031245
75. Amarasekara D.S., Yun H., Kim S., Lee N., Kim H., Rho J. Regulation of Osteoclast Differentiation by Cytokine Networks. Immune Netw. 2018;18(1):e8. DOI: 10.4110/in.2018.18.e8
76. D’Oronzo S., Coleman R., Brown J., Silvestris F. Metastatic bone disease: Pathogenesis and therapeutic options: Up-date on bone metastasis management. J Bone Oncol. 2018;15:004–4. DOI: 10.1016/j. jbo.2018.10.004
77. Gabrilovich D.I. Myeloid-derived suppressor cells. Cancer Immunol Res. 2017;5(1):3–8. DOI: 10.1158/2326-6066.CIR-16-0297
78. Botta C., Gullà A., Correale P., Tagliaferri P., Tassone P. Myeloidderived suppressor cells in multiple myeloma: pre-clinical research and translational opportunities. Front Oncol. 2014;4:348. DOI: 10.3389/fonc.2014.00348
79. Cook K.D., Finger E.C., Santos C.D., Rock D.A. A quantitative method for detection of circulating fms related tyrosine kinase 3 (FLT-3) in acute myeloid leukemia (AML) patients. J Immunol Methods. 2019;470:55–8. DOI: 10.1016/j.jim.2019.04.010
80. Schrijver I.T., Théroude C., Roger T. Myeloid-derived suppressor cells in sepsis. Front Immunol. 2019;10:327. DOI: 10.3389/fimmu.2019.00327
81. Dysthe M., Parihar R. Myeloid-derived suppressor cells in the tumor microenvironment. Adv Exp Med Biol. 2020;1224:117–40. DOI: 10.1007/978-3-030-35723-8_8
82. Groth C., Hu X., Weber R., Fleming V., Altevogt P., Utikal J., et al. Immunosuppression mediated by myeloid-derived suppressor cells (MDSCs) during tumour progression. Br J Cancer. 2019;120(1):16–25. DOI: 10.1038/s41416-018-0333-1
83. Mortezaee K. Myeloid-derived suppressor cells in cancer immunotherapy-clinical perspectives. Life Sci. 2021;277:119627. DOI: 10.1016/j.lfs.2021.119627
84. Pan Y., Yu Y., Wang X., Zhang T. Tumor-associated macrophages in tumor immunity. Front Immunol. 2020;11:583084. DOI: 10.3389/fimmu.2020.583084
Об авторах
О. А. БейлерлиРоссия
Бейлерли Озал Арзуман оглы — к.м.н., старший научный сотрудник
Республика Башкортостан, Уфа
И. Ф. Гареев
Россия
Гареев Ильгиз Фанилевич — к.м.н., старший научный сотрудник
Республика Башкортостан, Уфа
В. Н. Павлов
Россия
Павлов Валентин Николаевич — д.м.н., профессор, академик РАН, кафедра урологии
Республика Башкортостан, Уфа
Э. Р. Мусаев
Россия
Мусаев Эльмар Расим оглы — д.м.н., профессор, член-корр. РАН, кафедра онкологии
Москва
Г. Е. Чмутин
Россия
Чмутин Геннадий Егорович — д.м.н., профессор, кафедра нервных болезней и нейрохирургии им. Ю.С. Мартынова
Москва
Ч. Вонг
Китай
Вонг Чунлеи — профессор, отделение нейрохирургии
Харбин
Рецензия
Для цитирования:
Бейлерли О.А., Гареев И.Ф., Павлов В.Н., Мусаев Э.Р., Чмутин Г.Е., Вонг Ч. Механизмы метастазирования в позвоночник: новые перспективы. Креативная хирургия и онкология. 2024;14(2):163-173. https://doi.org/10.24060/2076-3093-2024-14-2-163-173
For citation:
Beylerli O.A., Gareev I.F., Pavlov V.N., Musaev E.R., Chmutin G.E., Wang C. Mechanisms of Spinal Metastases: New Perspectives. Creative surgery and oncology. 2024;14(2):163-173. (In Russ.) https://doi.org/10.24060/2076-3093-2024-14-2-163-173
JATS XML


































