Перейти к:
Химиолучевое лечение глиомы ствола мозга. Особенности физико-дозиметрического планирования (клинический случай)
https://doi.org/10.24060/2076-3093-2025-15-3-299-307
Аннотация
Введение. При глиомах ствола мозга медиана общей выживаемости составляет от 6 до 16 месяцев. Существующие подходы к лечению глиом стволовой локализации не показали значимого улучшения выживаемости, поэтому особенно актуален вопрос поиска новых лечебных стратегий. Материалы и методы. В радиотерапевтическом отделении № 1 БУЗ ВО «ВОНКОЦ» проходила лечение пациентка с диагнозом: глиома grade 4 правого таламуса, заднего бедра внутренней капсулы, правой ножки мозга. Диагноз выставлен клинико-рентгенологически. Тактика лечения: лучевая терапия до СОД 60 Гр: РОД 2 Гр с темозоломидом. Результаты. Проведен курс химиолучевого лечения: дистанционная лучевая терапия по методике IMRT совместно с приемом темозоломида 75 мг/м² /сут. Предписанная доза для пораженной области вне ствола составила 60 Гр, для области, включающей ствол мозга,— 56 Гр. Переносимость лечения была удовлетворительной. Явлений токсичности и прогрессирования неврологического дефицита не отмечалось. Обсуждение. По данным большинства научных исследований, лучевая терапия с СОД 54 Гр — проверенный терапевтический вариант при лечении глиом стволовой локализации. Есть исследования, показывающие, что максимальная толерантная доза на ствол мозга может быть увеличена до 64 или 69,59 Гр. Таким образом, выбор предписанной дозы в рассмотренном клиническом случае выглядит несколько заниженным. Однако в процессе планирования была поставлена задача добиться однородного дозового распределения. В дальнейшем при первичных образованиях ствола мозга видится целесообразным использование 58 Гр в качестве предписанной дозы при соблюдении прочих необходимых критериев. Заключение. В рассмотренном клиническом случае становится возможным подведение суммарной дозы 56–60 Гр на значительный объем опухоли ствола мозга с учетом имеющихся критериев толерантности с достижением удовлетворительного покрытия дозой и отсутствием развития серьезных неврологических осложнений у пациента в ходе лечения.
Для цитирования:
Никульшина Я.О., Клиновицкая М.И., Бакутина Л.С. Химиолучевое лечение глиомы ствола мозга. Особенности физико-дозиметрического планирования (клинический случай). Креативная хирургия и онкология. 2025;15(3):299-307. https://doi.org/10.24060/2076-3093-2025-15-3-299-307
For citation:
Nikulshina Ya.O., Klinovitskaya M.I., Bakutina L.S. Chemoradiation Treatment of Brainstem Glioma. Features of Physical and Dosimetric Planning (A Clinical Case). Creative surgery and oncology. 2025;15(3):299-307. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-299-307
ВВЕДЕНИЕ
Заболеваемость первичными опухолями центральной нервной системы (ЦНС) в мире — 25,34 на 100 тысяч населения [1]. В России в 2023 году заболеваемость среди мужчин и женщин составила 6,3 и 5,7 на 100 тысяч населения соответственно [2]. Среди первичных опухолей ЦНС преобладают глиомы, составляя 35,5 % [1]. Глиомы ствола мозга встречаются сравнительно редко, составляя 1,5–2,5 % всех глиом. Хотя опухоли данной локализации могут диагностироваться в любом десятилетии жизни, в основном они встречаются у пациентов старше 40 лет [3] и, как правило, имеют низкую степень злокачественности (WHO grade I–II) [1][4]. При этом при инфильтративных глиомах ствола мозга у взрослых высокой степени злокачественности (WHO grade III–IV) медиана общей выживаемости составляет от 6 до 16 месяцев [4].
Глиомы ствола мозга чаще всего локализуются в мосту (60 %), реже в продолговатом (25 %) и среднем мозге (12–15 %). Гистологически глиомы ствола мозга могут быть астроцитарными, олигодендроглиальными или смешанными [4][5]. Среди глиом ствола в отдельную группу выделяют диффузную глиому ствола. В данную группу входят глиальные опухоли низкой (grade I–II) и высокой (grade III–IV) степени злокачественности — диффузные глиомы, характеризующиеся быстрым ростом, неблагоприятным клиническим прогнозом и резистентностью к лекарственному лечению [5–7]. До 90 % диффузных глиом ствола содержат патогномоничную мутацию в генах H3F3A (до 65 % опухолей) и HIST1H3B (до 25 % опухолей) [8].
Опухоли ствола мозга характеризуются альтернирующей неврологической симптоматикой и на поздних стадиях — внутричерепной гипертензией. Опухоли задней черепной ямки проявляются нарушением функций вовлеченных в процесс черепных нервов, а также признаками сдавления мозжечка, ствола мозга и внутричерепной гипертензии [8]. Иногда клиническое ухудшение может предшествовать рентгенологическому прогрессированию [5][8].
В большинстве случаев при глиомах ствола мозга хирургическое лечение невозможно в связи с инфильтративным характером роста в пределах стволовых структур. В некоторых случаях возможно проведение стереотаксической биопсии для морфологической верификации и определения молекулярно-генетического статуса опухоли [7][8]. Однако материал, полученный при стереотаксической биопсии, зачастую не отражает гистологическую и молекулярно-генетическую гетерогенность опухоли. По этой причине в ряде случаев диагноз глиальных опухолей ствола выставляется клинико-рентгенологически [4][7].
Наиболее эффективным методом лечения злокачественной глиомы ствола мозга с учетом невозможности и нецелесообразности тотальной хирургической резекции является химиолучевое лечение. Стандартный подход в лучевой терапии глиом ствола мозга — это традиционное (конвенциональное) фракционирование до суммарной очаговой дозы 54–60 Гр с разовой очаговой дозой 1,8–2 Гр за фракцию в течение 5–6 недель [7][8]. Согласно Клиническим рекомендациям Министерства здравоохранения Российской Федерации стратегия послеоперационного лечения глиом высокой степени злокачественности предусматривает химиолучевое лечение: лучевая терапия в режиме стандартного фракционирования (2 Гр за фракцию) в суммарной очаговой дозе 60 Гр совместно с приемом темозоломида в дозе 75 мг/м²/сутки на весь период лечения с последующим приемом темозоломида в адъювантном режиме (8–12 курсов). При лечении глиом ствола мозга рекомендуется применение стереотаксической техники облучения до СОД 54 Гр за 30 фракций [9].
При планировании лучевой терапии в процессе оконтуривания врач-радиотерапевт определяет оптимальные целевые объемы облучения (GTV, CTV, PTV) и отграничивает анатомические структуры, расположенные рядом с опухолью. Несмотря на большое число исследований в данной области, нет единого мнения относительно оптимальных границ целевых объемов для глиом высокой степени злокачественности, в том числе стволовой локализации [10]. Хотя Европейская организация по исследованию и лечению рака (EORTC) и Ассоциация терапевтической радиационной онкологии (RTOG) использовали различные подходы к определению целевых объемов при глиомах высокой степени злокачественности, обе группы исследователей рекомендовали отступ от GTV на 2 см для формирования CTV для охвата области потенциальной микроскопической опухолевой инфильтрации [10–12]. GTV, в свою очередь, определяется как зона послеоперационных изменений, а также любая остаточная опухоль, имеющая, как правило, гиперинтенсивный МР-сигнал на постконтрастных T1-взвешенных изображениях, без учета зоны перитуморального отека [11–14]. Хотя нет убедительных данных, свидетельствующих о том, что включение перитуморального отека в зону CTV достоверно улучшает результаты лечения, зоны гиперинтенсивного МР-сигнала на T2 и T2-Flair могут свидетельствовать о наличии опухолевой инфильтрации и определяться как область инфильтративно-отечных изменений [11][13–20].
Объем PTV формируется за счет отступа 3–5 мм от CTV в соответствии с характеристиками аппарата лучевой терапии, системы фиксации и навигации с поправкой на критические структуры. Tinkle и соавт. проанализировали случаи прогрессирования глиом стволовой локализации у пациентов, получавших лечение со стандартными (1 см) или расширенными (2–3 см) отступами на CTV. Из 93 пациентов у 87 % наблюдалось локальное прогрессирование. Выживаемость без прогрессирования и общая выживаемость существенно не отличались в зависимости от величины отступа на CTV. Эти данные свидетельствуют о том, что увеличение отступа на CTV более чем на 1 см неоправданно, учитывая отсутствие очевидной клинической пользы и высокий риск повреждения критических структур [21]. Использование перфузионно- и диффузионно-взвешенной МРТ и аминокислотных ПЭТ-индикаторов MET, FET и FDOPA может помочь в выявлении областей опухолевой инфильтрации, выходящих за рамки обычной МРТ [22–24].
В случае первичного химиолучевого лечения глиом ствола мозга с темозоломидом 9-месячная выживаемость пациентов, согласно имеющимся данным, составляет 56 %, 1-летняя — 35 %, 2-летняя — 17 %, медиана общей выживаемости — 9,5 месяца [7][25]. В настоящее время нет разницы в стандартах лечения глиом головного мозга с мутацией H3K27-М и без нее. Поэтому при прогрессировании злокачественной диффузной глиомы ствола используются те же лекарственные препараты, что и при прогрессировании любой глиомы высокой степени злокачественности [7][25]. Вариантом выбора при прогрессировании злокачественной диффузной глиомы ствола является бевацизумаб — лекарственный препарат на основе антител к фактору роста эндотелия сосудов (VEGF). Также используются препараты из группы производных нитрозомочевины: ломустин, кармустин и фотемустин [7][25][26].
Несмотря на недавние достижения в области медицины, включая молекулярные, визуализационные и терапевтические аспекты, лечение глиом ствола остается одной из самых сложных проблем в онкологии. На сегодняшний день многочисленные клинические испытания изучили потенциальные терапевтические возможности при глиомах ствола и не показали значимого улучшения выживаемости, поэтому особенно актуален вопрос поиска новых лечебных стратегий.
МАТЕРИАЛЫ И МЕТОДЫ
В радиотерапевтическое отделение № 1/дневной стационар БУЗ ВО «ВОНКОЦ» поступила на лечение пациентка 1977 г. р. с диагнозом: глиома grade 4 правого таламуса, заднего бедра внутренней капсулы, правой ножки мозга. На протяжении 3 месяцев пациентка отмечала прогрессирующую слабость в левой руке и ноге, нарушение координации движений, приступы панического страха. Гистологическое исследование операционного материала не проводилось, т. к. в соответствии с заключением онкоконсилиума в НМИЦ нейрохирургии им. Н. Н. Бурденко проведение стереотаксической биопсии сопряжено с высоким риском развития тяжелых неврологических осложнений: параличи и парезы, бульбарный синдром (расстройства дыхания, глотания, сердечной деятельности, тонуса сосудов), нарушение речи, летальный исход. Было принято решение провести лечение без хирургической верификации и расценить опухоль как глиобластому (глиому grade 4) по клинико-рентгенологическим данным. По данным МРТ головного мозга определяются МР-признаки внутримозгового солидного образования правой гемисферы головного мозга, вовлекающего ножку мозга, таламус, тело и хвост хвостатого ядра, наиболее вероятно, злокачественного генеза (рис. 1). Представленные МРТ-исследования выполнялись в отделении лучевой диагностики БУЗ ВО «ВОНКОЦ» на аппаратах: магнитно-резонансный томограф Philips Ingenia 1.5T и Philips Ingeniа Аmbition 1,5 Т.
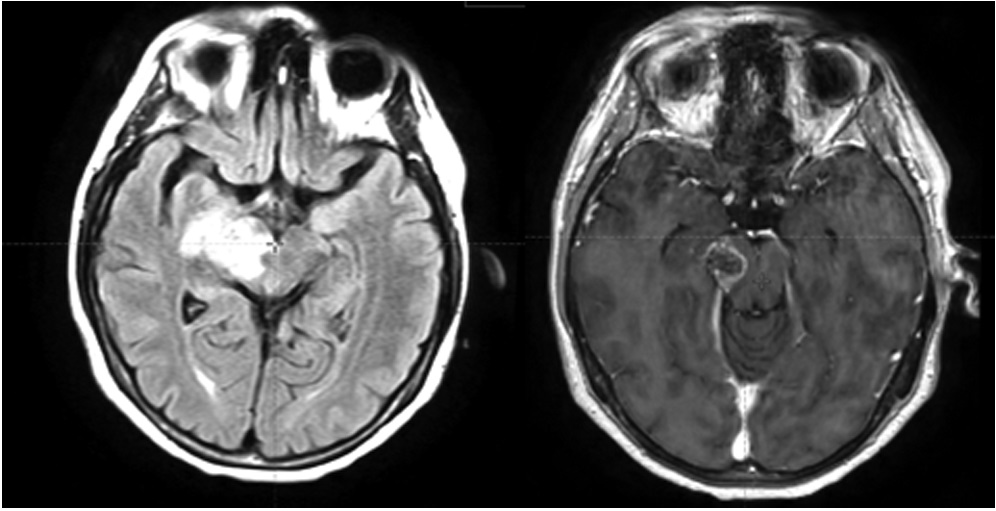
Рисунок 1. МРТ головного мозга: импульсные последовательности T2 Flair и T1 с контрастированием
Figure 1. Brain MRI: T2 Flair and T1 pulse sequences with contrast
В соответствии с решением онкоконсилиума в НМИЦ нейрохирургии им. Н. Н. Бурденко выработана тактика лечения: лучевая терапия на опухоль ствола мозга до СОД 60 Гр: РОД 2 Гр с темозоломидом 75 мг/м² на весь период лучевой терапии.
Целевые объемы облучения определялись на основании данных предоперационной и послеоперационной магнитно-резонансной томографии (МРТ) головного мозга, выполненной на высокопольном МР-томографе (1,5 Тл) с внутривенным контрастным усилением, и компьютерной томографии с толщиной среза 3 мм:
- GTV = зона опухоли, соответствующая области накопления контрастного вещества на постконтрастных T1-взвешенных изображениях, распространяющаяся на ножку мозга, таламус, тело и хвост хвостатого ядра;
- СTV = зона перифокального гиперинтенсивного МР-сигнала на T2 и T2 Flair взвешенных изображениях, окружающая область накопления контрастного вещества (GTV), соответствующая инфильтративно-отечным изменениям;
- PTV = CTV + 2 мм в соответствии с характеристиками аппарата лучевой терапии, системы фиксации и навигации с поправкой на критические структуры.
Лучевая терапия проводилась на линейных ускорителях Varian Halcyon с энергией 6 мэВ.
В процессе физико-дозиметрического планирования основной проблемой было соблюдение ограничений для ствола мозга при предписанной дозе в 60 Гр, поскольку в соответствии с критериями толерантности дозы QUANTEC имеются следующие ограничения для конвенционального фракционирования (≤2 Гр за фракцию) при условии вероятности возникновения тяжелой неврологической токсичности или лучевого некроза менее 5 %:
1) весь ствол мозга может получить дозу не более 54 Гр;
2) объем 1–10 см³ может получить дозу не более 59 Гр;
3) максимально допустимая доза в точке (<<1 см³) 64 Гр.
После оконтуривания целевых объемов и критических структур врачом-радиотерапевтом физико-дозиметрический расчет осуществлялся медицинским физиком с использованием системы планирования лучевой терапии Eclipse (версия 16.1) от Varian Medical Systems, входящей в состав Siemens Healthineers. Лечение пациента проводилось на линейном ускорителе электронов Varian Halcyon с энергией 6 МВ.
РЕЗУЛЬТАТЫ
С учетом текущих критериев толерантности критических структур, было принято компромиссное решение ограничить область пересечения всего облучаемого объема и объема лечения, включающего ствол мозга, дозой 59 Гр, а максимальную дозу в контуре PRV (отступ от ствола мозга изотропно 2 мм) для учета геометрической неопределенности снизить до 60 Гр. Выполнение указанных критериев сопоставимо с методикой симультанного интегрированного буста (simultaneous-integrated boost, SIB), т. к. в одном объеме облучения появляются две области с разной предписанной дозой.
Эмпирическим путем было установлено, что 56 Гр является оптимальной суммарной дозой для облучения объема ствола мозга, подлежащего лечению. Такая величина дозы одновременно позволяет небольшие гетерогенности распределения дозы и в то же время обеспечивает достаточную однородность и гомогенность покрытия, исключая значительные «горячие» и «холодные» островки в дозовом распределении. Ключевые критерии для мишеней, гарантирующие их покрытие и гомогенность:
1) V 98 % > 95 % (допускается 93 %) — 98 % предписанной дозы должно покрывать не менее 95 % (93 %) объема мишени;
2) V 107 % < 2 % — 107 % предписанной дозы не должно покрывать более 2 % объема мишени;
3) Dmax < 110 % — максимальное значение дозы во всем объеме лечения не должно превышать 110 % от наибольшей предписанной дозы, т. е. от 60 Гр.
Для планирования были созданы следующие объемы мишеней:
1) mp_PTV60, mp_GTV60 — объемы мишени, исключающий PRV ствола мозга, с предписанной дозой 60 Гр;
2) mp_PTV56, mp_GTV56 — объемы мишени, охватывающие ствол мозга, с предписанной дозой 56 Гр.
Здесь и далее все структуры, содержащие в начале названия mp (сокр. от medical physicist), являются контурами медицинского физика.
Итоговый план, реализованный на ускорителе электронов Halcyon (Varian) с энергией фотонов 6 МВ, содержит 11 полей IMRT (Intensity Modulated Radiation Therapy) (рис. 2, 3).
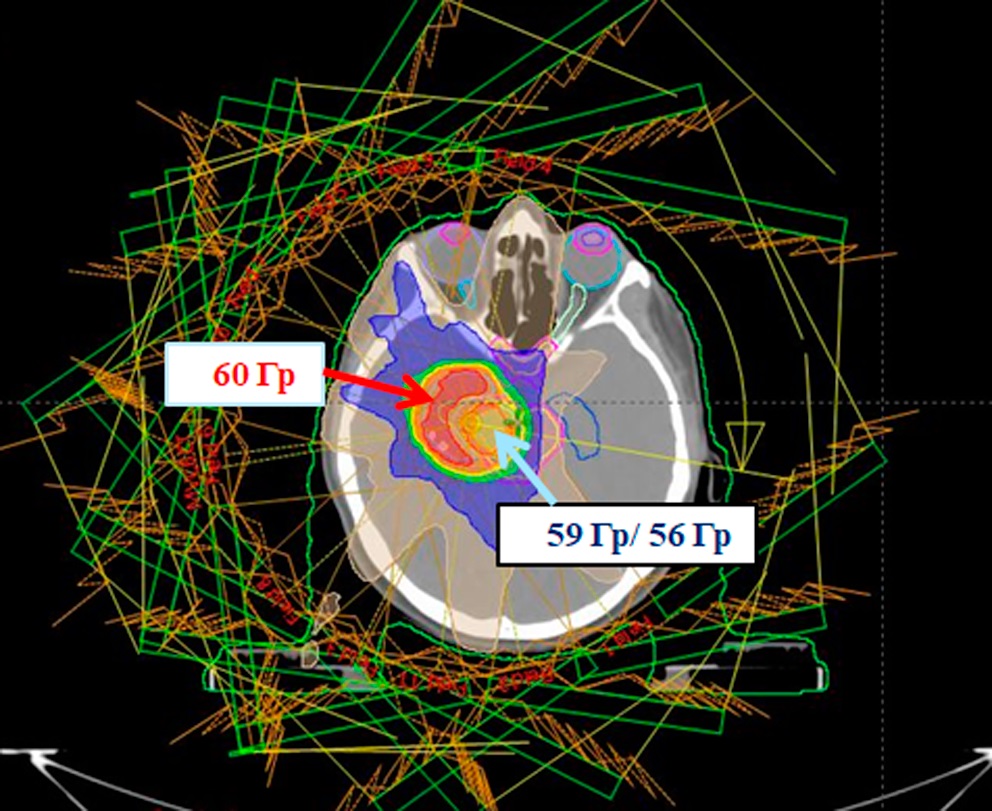
Рисунок 2. Объемы облучения: область ствола (59 Гр/эмпирически 56 Гр): mp_PTV56, mp_GTV56 (голубая стрелка) и пораженная область вне стволовой локализации (60 Гр) mp_PTV60, mp_GTV60 (красная стрелка); красным цветом обозначена область, получающая 60 Гр, оранжевым — 59 Гр, желтым — 56 Гр, зеленым — 44,8 Гр (80 % от 56 Гр), синим — 28 Гр (50 % от 56 Гр)
Figure 2. Irradiation volumes: stem area (59 Gy/empirically 56 Gy): mp_PTV56, mp_GTV56 (blue arrow) and the affected area outside the stem localization (60 Gy) mp_PTV60, mp_GTV60 (red arrow); red indicates the area receiving 60 Gy, orange — 59 Gy, yellow — 56 Gy, green — 44.8 Gy (80 % of 56 Gy), blue — 28 Gy (50 % of 56 Gy)
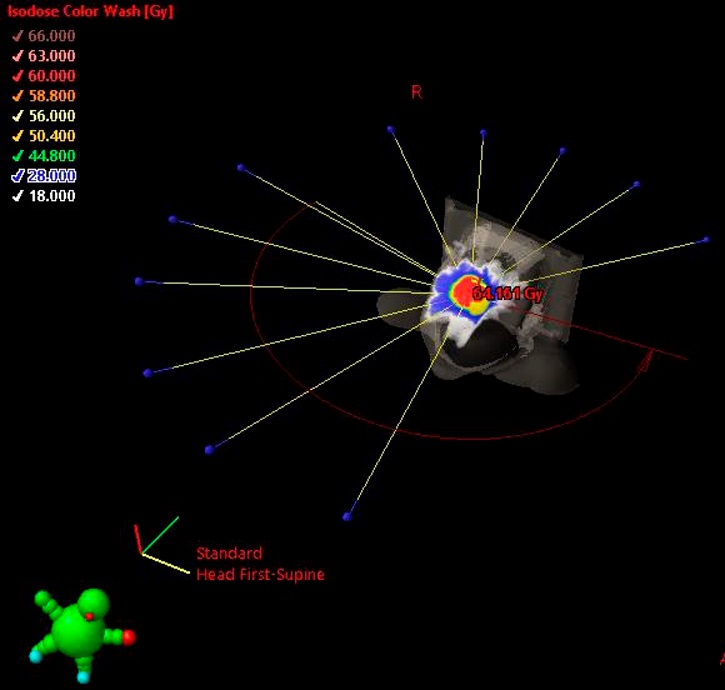
Рисунок 3. Расположение 11 полей IMRT в конечном варианте расчета
Figure 3. Localization of the 11 IMRT fields in the final calculation version
В результате планирования удалось выполнить критерии для ствола мозга и PRV объема ствола мозга (рис. 4): максимальная доза в точке для ствола мозга не превышает 59 Гр, для PRV объема ствола мозга — меньше 60 Гр.
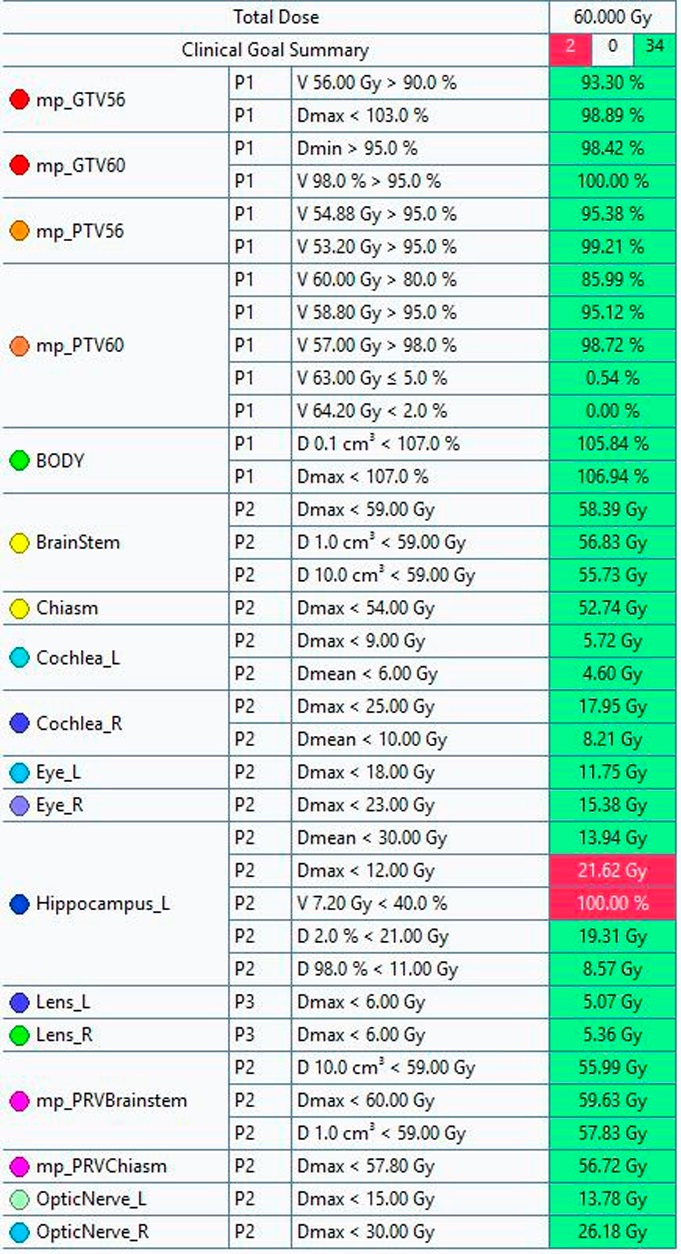
Рисунок 4. Итоговые результаты планирования: 1 столбец — наименование критической структуры; 2 столбец — приоритет выполнения критерия (от P1 до P3 уменьшается значимость); 3 столбец — критерии оценки плана; 4 столбец — актуальное значение критерия (зеленый цвет обозначает выполнение критерия, красный — невыполнение)
Figure 4. Final planning results: Column 1 — name of the critical structure; Column 2 — priority of criterion fulfillment (from P1 to P3, the importance decreases); Column 3 — plan evaluation criteria; Column 4 — current criterion value (green color indicates fulfillment of the criterion, red — non-fulfillment)
Проведен курс химиолучевого лечения: дистанционная лучевая терапия по методике IMRT на опухоль ствола мозга РОД 2 Гр: СОД 60 Гр за 30 фракций + темозоломид 75 мг/м²/сут на весь период проведения лучевой терапии на фоне симптоматической противоотечной терапии: Sol. Dexamethazoni 12 mg в/м ежедневно. Переносимость лечения была удовлетворительной, без необходимости в вынужденных перерывах. Явлений токсичности и прогрессирования неврологического дефицита не отмечалось. В настоящее время пациентка продолжает лечение: проходит курс адъювантной лекарственной терапии темозоломидом в монорежиме.
ОБСУЖДЕНИЕ
По данным актуальных научных публикаций, посвященных лечению глиом стволовой локализации, фотонная лучевая терапия в стандартном режиме фракционирования в рамках химиолучевого лечения с СОД 54 Гр остается проверенным терапевтическим вариантом при первичном лечении глиом стволовой локализации [5][6][9][23–25]. Так, общая выживаемость при таком подходе не изменилась за последние 20 лет и составляет от 11,5 до 15 месяцев. С учетом крайне неблагоприятного прогноза исследованы различные подходы к лучевой терапии, включающие использование как гиперфракционированного (6-дневный курс, РОД 1,17 Гр 2 раза в день до СОД 70,2 Гр), так и гипофракционированного (РОД 3 Гр, 5-дневные курсы до СОД 39 Гр) режимов. При первом подходе медиана выживаемости достигает 7,8 месяца, при втором — 8 месяцев [7][26][27]. Повторное облучение может быть вариантом выбора при прогрессировании заболевания, хотя в редких случаях оно приводит к увеличению риска развития неврологической токсичности. Таким образом, альтернативные схемы фракционирования для диффузной глиомы ствола, включая гиперфракционированные, ускоренные и гипофракционированные режимы, не улучшают выживаемость, со значительно повышенным риском неврологической токсичности при достижении СОД >64 Гр [26][27].
В исследовании Panagiotis et al. была рассмотрена роль химиолучевого лечения пациентов с глиомами ствола мозга grade III и IV. Результаты показали, что добавление химиотерапии к лучевой терапии улучшает результаты лечения при глиомах grade IV, но достоверно не улучшает показатели выживаемости при глиомах grade III [28]. Другая ретроспективная серия клинических исследований глиом стволовой локализации продемонстрировала улучшение выживаемости пациентов с глиомами grade III и IV степени по классификации ВОЗ, получавших химиолучевое лечение с последующим адъювантным лечением темозоломидом, по сравнению с пациентами, получавшими только лучевую терапию [29]. Следует отметить, что при H3-K27M-мутантной диффузной глиоме ствола IV степени по ВОЗ промотор MGMT (O6-метилгуанин–ДНК-метилтрансфераза), являющийся признанным прогностическим биомаркером, обычно неметилирован, что указывает на меньшую эффективность алкилирующей химиотерапии темозоломидом [28][29].
В рассмотренном клиническом случае в ходе физико-дозиметрического планирования удалось выполнить все поставленные критерии, за исключением ряда ограничений для левого гиппокампа, который достаточно близко прилегает к объему облучения (см. рис. 3): максимальная доза в точке для ствола мозга не превышает 59 Гр, для PRV объема ствола мозга — меньше 60 Гр.
Оба критерия для гиппокампа приведены в работе Bisello et al. [30]. В свою очередь, критерий Dmax < 12 Гр неявным образом отображается в исследовании Paun et al. [31] при тотальном облучении всего головного мозга с обхождением гиппокампов (Hippocampal Avoidance Whole Brain Radiation Therapy, далее HA-WBRT). В приведенной работе сравниваются 2 режима фракционирования — 30 Гр в 15 фракций (2 Гр/фр) и 35 Гр в 14 фракций (2.5 Гр/фр). Авторы данной работы не дают четкого ограничения ни для одного режима, однако для обоих фигурирует средняя доза в 12 Гр, а не максимальная. В любом случае можно сделать «поправку» на неконвенциональный режим фракционирования, воспользовавшись формулой линейно-квадратичной модели, приняв параметр a/b равным 2 Гр и 10 Гр, как и предлагают авторы работы выше. Тогда максимальная (или средняя) доза для конвенционального фракционирования, с учетом того что 12 Гр можно расценивать как ограничение для облучения 2.5 Гр/фр, увеличивается до 12.5 Гр при a/b = 10 Гр и 13.5 Гр при a/b = 2 Гр, что, однако, в конечном итоге все равно не выполняется (рис. 3). Помимо указанного максимального значения, существует также критерий Dmax < 16 Гр для режима HA-WBRT с интегральной дозой 30 Гр и разовыми дозами 2.5 Гр/фр или 3 Гр/фр. В пересчете на стандартное фракционирование максимальная доза для 2,5 Гр/фр и 3 Гр/фр равна 18 Гр и 20 Гр для a/b = 2 Гр и 16,7 Гр и 17,4 Гр для a/b = 10 Гр соответственно.
Ни одно из указанных дозовых ограничений для гиппокампов, в том числе V 7.2 Гр < 40 %, полученное в работах с первичными опухолями ЦНС [32], в текущем плане не выполняется, по мнению авторов, по следующим причинам:
— анатомическая близость к облучаемому объему;
— большая предписанная доза (интегральная доза для WBRT в конвенциональном фракционировании не превышает 40 Гр).
В качестве решения или как минимум улучшения дозового распределения, в частности по гиппокампу, можно предположить лечение на аппарате с возможностью поворота стола. В таком случае целесообразно использование некомпланарных ротационных полей, что позволяет более гибко обходить критические структуры, в то же время обеспечивая выполнение заданных критериев для покрытия мишени. Из-за отсутствия такой возможности при создании данного плана предпочтение было отдано методике IMRT, так как статичные поля создают больший спад дозы, чем ротационная методика без поворота стола, несмотря на некоторую угловатость дозового распределения (см. рис. 2, 3).
Что касается дозовых ограничений для ствола мозга, то с середины прошлого века и до текущего момента они претерпели ряд изменений как в сторону уменьшения, так и в сторону увеличения. Одной из первых работ, резюмировавшей и объединившей отдельные исследования, считается работа B. Emami et al. [33]. Изначально в ней были введены следующие дозовые ограничения для стандартного фракционирования и 5 %-ной вероятности возникновения некроза в течение 5 лет, так называемый критерий TD5/5 (сокр. от tolerance dose):
- для 1/3 объема органа пороговая доза 60 Гр,
- для 2/3 объема органа пороговая доза 53 Гр,
- для 3/3, т. е. всего объема органа, пороговая доза 50 Гр.
В исследовании C. Mayo et al 2010 г. [34], на которое ссылается QUANTEC [35] и B. Emami [33], величина толерантной дозы для облучения всего объема ствола мозга может быть увеличена до 54 Гр, максимальная — до 64 Гр. В свою очередь, к объему 1–10 см³ может быть подведено 59 Гр, где 10 см³ можно представить в виде 1/3 объема среднестатистического ствола мозга. Одна из последних работ по лучевой терапии плоскоклеточного рака носоглотки [36] и вовсе показывает, что максимальная доза для ствола мозга, при соответствии критерию TD5/5, может быть увеличена до 69,59 Гр.
Таким образом, выбор предписанной дозы для покрытия PTV со стволом мозга (mp_PTV56) в текущем случае выглядит несколько заниженным. Однако, как и было сказано, в процессе планирования была поставлена задача добиться однородного и гомогенного дозового распределения. В последующем при первичных образованиях ствола мозга видится целесообразным и перспективным использование суммарной дозы 58 Гр в качестве предписанной дозы при соблюдении прочих необходимых критериев.
ЗАКЛЮЧЕНИЕ
Лучевая терапия играет важную роль в лечении глиом ствола мозга. Учитывая ограниченную продолжительность жизни пациентов с глиомами данной локализации, лучевая терапия может использоваться для достижения временной стабилизации заболевания, уменьшения явлений неврологического дефицита и улучшения качества жизни. В рассмотренном клиническом случае благодаря высокой квалификации медицинского персонала, наличию современного оборудования, позволяющего осуществить сложный физико-дозиметрический расчет с применением методики IMRT, становится возможным подведение суммарной дозы 56–60 Гр на значительный объем опухоли ствола мозга с учетом всех имеющихся критериев толерантности с достижением удовлетворительного покрытия дозой и отсутствием развития серьезных неврологических осложнений у пациента в ходе лечения.
Список литературы
1. Price M., Ballard C., Benedetti J., Neff C., Cioffi G., Waite K.A., et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2017–2021. NeuroOncology. 2024;26(6):1–85. DOI: 10.1093/neuonc/noae145
2. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Состояние онкологической помощи населению России в 2023 году. Москва: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2024.
3. Reyes-Botero G., Mokhtari K., Martin-Duverneuil N., Delattre J.Y., Laigle-Donadey F. Adult brainstem gliomas. Oncologist. 2012;17(3):388–97. DOI: 10.1634/theoncologist.2011-0335
4. Leibetseder A., Leitner J., Mair M.J., Meckel S., Hainfellner J.A., Aichholzner M., et al. Prognostic factors in adult brainstem glioma: a tertiary care center analysis and review of the literature. J Neurol. 2022;269:1574–90. DOI: 10.1007/s00415-021-10725-0
5. Guillamo J.S., Monjour A., Taillandier L., Devaux B., Varlet P., HaieMeder C., et al. Association des Neuro-Oncologues d’Expression Française (ANOCEF). Brainstem gliomas in adults: prognostic factors and classification. Brain. 2001;124(12):2528–39. DOI: 10.1093/brain/124.12.2528. PMID: 11701605
6. Oronsky B., Reid T.R., Oronsky A., Sandhu N., Knox S.J. A review of newly diagnosed glioblastoma. Front Oncol. 2021;10(10):842–7. DOI: 10.3389/fonc.2020.574012
7. Крянев А.М., Розанов И.Д., Лебедев С.С., Греков Д.Н., Титов К.С., Якушева Т.А. и др. Диффузная срединная глиома ствола головного мозга: генетические особенности, сложности и перспективы лечения. Опухоли головы и шеи. 2024;14(1):49–55. DOI: 10.17650/2222-1468-2024-14-1-49-55
8. Гусев Е.И., Коновалов А.Н., Скворцова В.И. (ред.) Неврология: национальное руководство. М.: ГЭОТАР-Медиа; 2022.
9. Измайлов Т.Р., Усачев Д.Ю., Крылов В.В., Кобягов Г.Л., Абсалямова О.В., Бекяшев А.А. и др. (сост.) Первичные опухоли центральной нервной системы: Клинические рекомендации. М.; 2022.
10. Niyazi M., Brada M., Chalmers A.J., Combs S.E., Erridge S.C., Fiorentino A., et al. ESTRO-ACROP guideline “target delineation of glioblastomas”. Radiother Oncol. 2016;118(1):35–42. DOI: 10.1016/j.radonc.2015.12.003
11. Oppitz U., Maessen D., Zunterer H., Richter S., Flentje M. 3D-recurrence-patterns of glioblastomas after CT-planned postoperative irradiation. Radiother Oncol. 1999;53(1):53–7. DOI: 10.1016/s0167-8140(99)00117-6
12. Gebhardt B.J., Dobelbower M.C., Ennis W.H., Bag A.K., Markert J.M., Fiveash J.B. Patterns of failure for glioblastoma multiforme following limited-margin radiation and concurrent temozolomide. Radiat Oncol. 2014;9:130. DOI: 10.1186/1748-717X-9-130
13. Navarria P., Pessina F., Franzese C., Tomatis S., Perrino M., Cozzi L., et al. Hypofractionated radiation therapy (HFRT) versus conventional fractionated radiation therapy (CRT) for newly diagnosed glioblastoma patients. A propensity score matched analysis. Radiother. Oncol. 2018;127(1):108–13. DOI: 10.1016/j.radonc.2017.12.006
14. Azoulay M., Chang S.D., Gibbs I.C., Hancock S.L., Pollom E.L., Harsh G.R., et al. A phase I/II trial of 5-fraction stereotactic radiosurgery with 5-mm margins with concurrent temozolomide in newly diagnosed glioblastoma: primary outcomes. Neuro-Oncol. 2020;22(8):1182–9. DOI: 10.1093/neuonc/noaa019
15. Guram K., Smith M., Ginader T., Bodeker K., Pelland D., Pennington E., et al. Using smaller-than-standard radiation treatment margins does not change survival outcomes in patients with high-grade gliomas. Pract Radiat Oncol. 2019;9(1):16–23. DOI: 10.1016/j.prro.2018.06.001
16. Minniti G., Tini P., Giraffa M., Capone L., Raza G., Russo I., et al. Feasibility of clinical target volume reduction for glioblastoma treated with standard chemoradiation based on patterns of failure analysis. Radiother Oncol. 2023;181:109435. DOI: 10.1016/j.radonc.2022.11.024
17. Kumar N., Kumar R., Sharma S.C., Mukherjee A., Khandelwal N., Tripathi M., et al. Impact of volume of irradiation on survival and quality of life in glioblastoma: a prospective, phase 2, randomized comparison of RTOG and MDACC protocols. Neurooncol Pract. 2020;7(1):86–93. DOI: 10.1093/nop/npz024
18. Karschnia P., Young J.S., Dono A., Häni L., Sciortino T., Bruno F., et al. Prognostic validation of a new classification system for extent of resection in glioblastoma: A report of the RANO resect group. NeuroOncol. 2023;25(5):940–54. DOI: 10.1093/neuonc/noac193
19. Hayes A.R., Jayamanne D., Hsiao E., Schembri G.P., Bailey D.L., Roach P.J., et al. Utilizing 18F-fluoroethyltyrosine (FET) positron emission tomography (PET) to define suspected nonenhancing tumor for radiation therapy planning of glioblastoma. Pract Radiat Oncol. 2018;8(4):230–8. DOI: 10.1016/j.prro.2018.01.006
20. Fleischmann D.F., Unterrainer M., Schön R., Corradini S., Maihöfer C., Bartenstein P., et al. Margin reduction in radiotherapy for glioblastoma through 18F-fluoroethyltyrosine PET? — A recurrence pattern analysis. Radiother Oncol. 2020;145:49–55. DOI: 10.1016/j.radonc.2019.12.005
21. Tinkle C.L., Duncan E.C., Doubrovin M., Han Y., Li Y., Kim H., et al. Evaluation of 11C-methionine PET and anatomic MRI associations in diffuse intrinsic pontine glioma. J Nuclear Med. 2019;60(3):312–9. DOI: 10.2967/jnumed.118.212514
22. Brat D.J., Aldape K., Colman H., Holland E.C., Louis D.N., Jenkins R.B., et al. cIMPACT-NOW update 3: recommended diagnostic criteria for “Diffuse astrocytic glioma, IDH-wildtype, with molecular features of glioblastoma, WHO grade IV”. Acta Neuropathol. 2018;136(5):805–10. DOI: 10.1007/s00401-018-1913-0
23. Tesileanu C.M.S., Dirven L., Wijnenga M.M.J., Koekkoek J.A.F., Vincent A.J.P.E., Dubbink H.J., et al. Survival of diffuse astrocytic glioma, IDH1/2 wildtype, with molecular features of glioblastoma, WHO grade IV: a confirmation of the cIMPACT-NOW criteria. Neuro-Oncol. 2020;22(4):515–23. DOI: 10.1093/neuonc/noz200
24. Louis D.N., Perry A., Wesseling P., Brat D.J., Cree I.A., FigarellaBranger D., et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro-Oncol. 2021;23(8):1231–51. DOI: 10.1093/neuonc/noab106
25. Ferrat D., Murat B., Omer S., Selcuk D., Bora U., Hakan G., et al. Review of dose fractionation schemes for pontine glioma irradiation. J Surg Res. 2020;6(1):73–8. DOI: 10.17352/2455-2968.000101
26. Паньшин Г.А. К вопросу о современной радиотерапии глиом ствола головного мозга у взрослых пациентов. Трудный пациент. 2021;19(2):54–6. DOI: 10.24412/2074-1995-2021-2-54-56
27. Улитин А.Ю., Желудкова О.Г., Иванов П.И., Кобяков Г.Л., Мацко М.В., Насхлеташвили Д.Р. и др. Первичные опухоли центральной нервной системы. Злокачественный опухоли. 2024;14(3s2- 1):183–211. DOI: 10.18027/2224-5057-2024-14-3s2-1.1-10
28. Panagiotis P., Goyal A., Lu V.M., Alvi M.A., Bydon M., Kizilbash S.H., et al. The role of radiation and chemotherapy in adult patients with high-grade brainstem gliomas: results from the National Cancer Database. J Neurooncol. 2020;146(2):303–10. DOI: 10.1007/s11060-019-03374-x
29. Theeler B.J., Ellezam B., Melguizo-Gavilanes I., de Groot J.F., Mahajan A., Aldape K.D., et al. Adult brainstem gliomas: Correlation of clinical and molecular features. J Neurol Sci. 2015;353(1-2):92–7. DOI: 10.1016/j.jns.2015.04.014
30. Bisello S., Cilla S., Benini A., Cardano R., Nguyen N.P., Deodato F., et al. Dose-volume Constraints fOr oRganS At risk In Radiotherapy (CORSAIR): An “All-in-One” multicenter-multidisciplinary practical summary. Curr Oncol. 2022;29(10):7021–50. DOI: 10.3390/curroncol29100552
31. Paun A., Fox J., Balloy V., Chignard M., Qureshi S.T., Haston C.K. Combined Tlr2 and Tlr4 deficiency increases radiationinduced pulmonary fibrosis in mice. Int J Radiat Oncol Biol Phys. 2010;77(4):1198–205. DOI: 10.1016/j.ijrobp.2009.12.065
32. Kharofa J., Cohen E.P., Tomic R., Xiang Q., Gore E. Decreased risk of radiation pneumonitis with incidental concurrent use of angiotensin-converting enzyme inhibitors and thoracic radiation therapy. Int J Radiat Oncol Biol Phys. 2012;84(1):238–43. DOI: 10.1016/j. ijrobp.2011.11.013
33. Emami B., Lyman J., Brown A., Cola L., Goitein M., Munzenrider J. E., et al. Tolerance of normal tissue to therapeutic irradiation. Int J Radiat Oncol Biol Phys. 1991;21(1):109–122. DOI: 10.1016/0360-3016(91)90171-y
34. Mayo C., Yorke E., Merchant T.E. Radiation associated brainstem injury. Int J Radiat Oncol Biol Phys. 2010;76(3 Suppl):S36–41. DOI: 10.1016/j.ijrobp.2009.08.078
35. Marks L.B., Yorke E.D., Jackson A. Use of normal tissue complication probability models in the clinic. Int J Radiat Oncol Biol Phys. 2010;76(3):36–41. DOI: 10.1016/j.ijrobp.2009.07.1754
36. Fan X., Huang Y., Xu P., Min Y., Li J., Feng M., et al. Dosimetric analysis of radiation-induced brainstem necrosis for nasopharyngeal carcinoma treated with IMRT. BMC Cancer. 2022;22:178. DOI: 10.1186/s12885-022-09213-z
Об авторах
Я. О. НикульшинаРоссия
Никульшина Яна Олеговна — радиотерапевтическое отделение № 1 / дневной стационар
Воронеж
М. И. Клиновицкая
Россия
Клиновицкая Марина Игоревна — физико-радиологическое отделение
Воронеж
Л. С. Бакутина
Россия
Бакутина Лилия Сергеевна — радиотерапевтическое отделение № 1 / дневной стационар
Воронеж
Рецензия
Для цитирования:
Никульшина Я.О., Клиновицкая М.И., Бакутина Л.С. Химиолучевое лечение глиомы ствола мозга. Особенности физико-дозиметрического планирования (клинический случай). Креативная хирургия и онкология. 2025;15(3):299-307. https://doi.org/10.24060/2076-3093-2025-15-3-299-307
For citation:
Nikulshina Ya.O., Klinovitskaya M.I., Bakutina L.S. Chemoradiation Treatment of Brainstem Glioma. Features of Physical and Dosimetric Planning (A Clinical Case). Creative surgery and oncology. 2025;15(3):299-307. (In Russ.) https://doi.org/10.24060/2076-3093-2025-15-3-299-307
JATS XML


































